微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)  MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 。
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示) 。
参考答案:(1)2 2 (2)4Cl2+8NaOH = 6NaCl+NaClO3+NaClO+4H2O
(3)Cl-+ClO-+2H+ = Cl2↑+H2O
本题解析:(1)当1mol Cl2参加反应时,由Cl2~2HCl可知被氧化的HCl为1mol×2=2mol,转移电子的物质的量为:1mol×(4-2)=2mol;(2)由题意可知反应物为氯气和氢氧化钠,生成物为NaCl、NaClO3、NaClO和H2O,氯元素从0价变为NaClO3中+5价,两个氯原子失10个电子,氯元素从0价变为NaCl中-1价,两个氯原子得到2个电子,所以氯化钠前得系数为6,氯酸钠前的系数为1,再根据原子守恒就可得到反应的化学方程式为:4Cl2+8NaOH = 6NaCl+NaClO3+NaClO+4H2O;(3)次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,故化学反应方程式为:Cl-+ClO-+2H+ = Cl2↑+H2O。
考点:MnO2与浓盐酸反应制取氯气
本题难度:一般
2、选择题 下列说法中不正确的是
A.根据某种原子的质量数可以确定该元素的相对原子质量
B.H-N=C=O与H-O-C N互为同分异构体
N互为同分异构体
C.化学键存在于化合物中,也可能存在于单质中
D.35Cl与37Cl是两种不同的核素
参考答案:A
本题解析:元素的相对原子质量是几种同位素的平均值,某个原子的质量数不能表示,A错误,其他选项均正确。答案选A。
点评:本题很基础简单,主要考查学生的基本概念。
本题难度:简单
3、选择题 下列用来表示物质变化时的化学用语中,正确的是?
A.氢硫酸溶液显酸性的主要原因:H2S 2H++ S2–
2H++ S2–
B.用稀氨水吸收H2S:NH3·H2O + H2S === NH4HS+ H2O
C.Na2CO3溶液显碱性的主要原因:CO32-+ 2H2O  H2CO3+ 2OH–
H2CO3+ 2OH–
D.CH3COOH(aq) + NaOH(aq) === CH3COONa (aq) + H2O(l) ΔH=" –57.3kJ/mol"
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列叙述正确的是(?)
A.元素的单质一定由氧化或还原该元素的化合物制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
参考答案:B
本题解析:A错误,元素的单质不一定由氧化或还原该元素的化合物制得,例如氧气可以用来制备臭氧;B正确,含有最高价元素的化合物不一定具有很强的氧化性,例如磷酸的氧化性不强;C错误,例如亚铁离子,可以失去电子被氧化为铁离子;在化学反应中,得电子越多的氧化剂,其氧化性没有必然的联系,故D错误。
点评:本题考查了化学术语,属于对基础知识的考查,该考有利于考查学生对基础知识的掌握情况,该题比较容易。
本题难度:一般
5、填空题 (3分)根据下列几种粒子的结构示意图,回答问题:(填粒子符号)
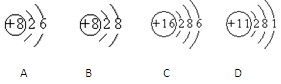
(1)其中属于阴离子的是?,
(2)属于金属元素的是?,
(3)具有相似化学性质的是?。
参考答案:①B②D③AC
本题解析:它们分别是氧原子、氧离子、硫离子、钠原子即⑴质子数<核外电子数的为阴离子,选B;⑵D;⑶最外层电子数相同化学性质相似,选AC。
本题难度:简单