微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生改进后的装置:

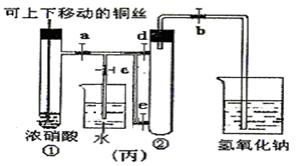
(1)写出铜和浓硝酸反应的化学方程式??。
(2)和甲装置相比,乙装置的优点??。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹??,再打开弹簧夹??,才能使NO2气体充满②试管。
(4)当气体充满②试管后,欲使烧杯中的水进入②试管应如何操作??。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O?(2分)
(2)①可以控制反应。②吸收NO2气体,防止污染环境。(2分)
(3)关闭c,d;打开a、b,e。(2分)
(4)先关闭b,迅速将铜丝提起与溶液脱离,再关闭a,e, 然后打开c,d,用手捂住②试管(热水、热毛巾、加热)。(合理答案均给分)?(2分)
本题解析:(1)硝酸具有强氧化性,能把铜氧化生成硝酸铜、NO2和水,方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
(2)乙中铜丝可以上下移动,因此便于控制反应;其次有尾气处理装置,吸收NO2气体,防止污染环境。
(3)NO2的密度大于空气的,所以应该是先关闭弹簧夹c、d,然后再打开弹簧夹a、b、e,才能时NO2气体充满试管②。
(4)欲使烧杯中的水进入②试管,则必须使NO2溶于水降低越强,所以正确的操作是先关闭b,迅速将铜丝提起与溶液脱离,再关闭a,e,然后打开c,d,用手捂住②试管(热水、热毛巾、加热)。
本题难度:一般
2、填空题 (15分)制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2。
II.对I中所得到的溶液按下列步骤进行提纯。
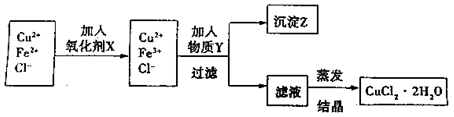
已知:
?
| 氢氧化物开 始沉淀时的pH 始沉淀时的pH
| 氢氧化物沉淀完全时的pH
|
Fe3+
| 1.9
| 3.2
|
Cu2+
| 4.7
| 6.7
|
?试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是? 。(填序号)
。(填序号)
A.KMnO4? B.K2Cr2O4? C.H2O2? D.NaClO
(2)①加紧入的物质Y是 ?。
?。
②写出沉淀Z在水中的沉淀溶解平衡方程式:?。
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2·2H2O),应采取的措施是?。?
(4)①某同学利用反应:Cu+2H+===Cu2 ++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为?。(填“原电池”或“电解池”)
++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为?。(填“原电池”或“电解池”)
②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。

(5)已知一些难溶物的浓度积常数如下表:
物质
| FeS
| MnS
| CuS
| PbS
| HgS
| ZnS
|
Ksp
| 6.3×10-18
| 2.5×-13
| 1.3×10-36
| 3.4×10-28
| 6.4×10-53
| 1.6×10-24
|
?某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的?除去它们。(选填序号)
①NaOH?②FeS?③Na2S
参考答案:(1)C(2分)?(2)①CuO或Cu(OH)2或CuCO3(2分)
②Fe(OH)5(s)) ?Fe2+(aq)+3OH-(aq)(2分)
?Fe2+(aq)+3OH-(aq)(2分)
(3)在HCl气流下加热浓缩,冷却结晶(2分)
(4)①电解池(2分)?②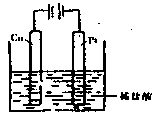 (3分)
(3分)
(5)②(2分)
本题解析:(1)除杂不能引入新的杂质,所以选择C。
(2)Y是来调节溶液的pH的,且不能引入新杂质,故可以选择uO或Cu(OH)2或CuCO3。
(3)氯化铜在溶液中发生水解,加热会进一步促进水解,所以必须在HCl气流下加热浓缩,冷却结晶。
(4)由Cu+2H+===Cu2 ++H2↑可知该装置只能是电解池,因为铜和酸反应不能置换出氢气。因为铜失去电子,所以只能作阳极,电解质含有氢离子的酸即可。
++H2↑可知该装置只能是电解池,因为铜和酸反应不能置换出氢气。因为铜失去电子,所以只能作阳极,电解质含有氢离子的酸即可。
(5)根据沉淀转化的实质②最好,①③属于可溶性物质,易引入新杂质。
本题难度:一般
3、选择题 下图是产生和收集气体的实验装置,该装置最适合于? ( )

A.用浓硝酸与Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2
D.用NH4Cl和Ca(OH)2反应制取NH3
参考答案:C
本题解析:A.用浓硝酸与Cu反应制取NO2,不能用排水法收集,不适合。
B.用浓盐酸和MnO2反应制取Cl2,需加热,不适合
C.用H2O2溶液和MnO2反应制取O2,正确
D.用NH4Cl和Ca(OH)2反应制取NH3,此反应需加热,不适合。
点评:掌握气体制取装置的选择方法。
本题难度:一般
4、选择题 用CuSO4·5H2O配制0.1 mol/L CuSO4溶液,下面所列的方法正确的是( ? )(CuSO4·5H2O的式量是250,CuSO4的式量是160)
A.取25 g CuSO4·5H2O溶于1 L水中
B.将CuSO4·5H2O干燥去掉结晶水,取16 g溶于水制成1 L溶液
C.将25 g CuSO4·5H2O溶于水制成1 L溶液
D.取12.5 g CuSO4·5H2O溶于500 mL水中
参考答案:C
本题解析:略
本题难度:简单
5、实验题 (11分)在实验室里用乙醇跟浓H2SO4反应制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
(1)用编号为①→④ 的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2和水蒸气。用装置的连接顺序(按产物气流从左到右的流向):
→? →? →? →。
(2)实验的装置①中A瓶的现象是________;结论为______________。
B瓶中的现象是________;B瓶溶液作用为________;
是否能将B瓶溶液换成酸性高锰酸钾______ (答是,否)。
(3)装置③中加的固体药品是________装置②中盛的溶液是________。
(4)装置④生成乙烯的反应类型是______;若要验证混合气体中有乙烯,应将混合气体先通过盛____________的洗气瓶,再通过盛______的试管中。?
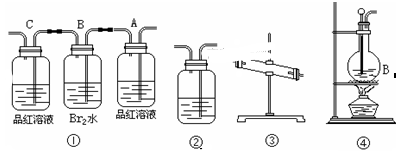
参考答案:(1)4→ 3? → 1? → 2? →;
(2)A瓶退色;含SO2;颜色变浅;吸收SO2(乙烯可答可不答);否;
(3)无水CuSO4,澄清石灰水;
(4)消去反应;NaOH溶液;溴水或酸性高锰酸钾溶液;
本题解析:(1)检验二氧化硫用品红溶液,检验二氧化碳用澄清的石灰水,检验水蒸气用无水硫酸铜,因溶液中有水,所以首先检验水蒸气;因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,二氧化硫能使品红褪色,二氧化碳不能,所以,检验二氧化硫在检验二氧化碳之前,再通过澄清石灰水确认CO2存在;(2)实验时装置①的作用是检验二氧化硫的存在并除去二氧化硫,A瓶中装有品红溶液,二氧化硫能使品红褪色,所以现象是品红褪色,说明混合气中有SO2;B装置吸收SO2,SO2+Br2+2H2O=2H2SO4+2HBr,现象是橙色褪去;C装置品红不褪色,说明SO2吸收完全。(3)装置③的作用是检验水蒸气,用白色的无水硫酸铜粉末,CuSO4+5H2O═CuSO4?5H2O变蓝说明混合气体中有水蒸气;装置②的作用是检验二氧化碳,用澄清石灰水,Ca(OH)2+CO2=CaCO3↓+H2O,澄清石灰水变浑浊,确认CO2存在。(4)装置④生成乙烯的反应类型是消去反应;若要验证混合气体中有乙烯,应将混合气体先通过盛NaOH溶液的洗气瓶,再通过盛溴水或酸性高锰酸钾溶液的试管中。
本题难度:一般