除杂试剂
甲烷(乙烯)
酒精(水)
参考答案:(1)大多数有机物难溶于水,易溶于有机溶剂,动、植物油属于油脂,不溶于水,溶于有机溶剂,故用水洗不掉,但可用汽油洗去,大多数有机物易燃烧,有机化工厂附近严禁火种,
故答案为:溶于水;溶于有机溶剂;易燃烧;
(2)乙烯能使酸性高锰酸钾溶于褪色,甲烷不可以,可以检验乙烯存在;甲烷不能与溴水反应,乙烯可以与溴水发生加成反应,可以利用溴水除去甲烷中的乙烯;
无水硫酸铜吸水变蓝色,据此检验水的存在,用新制的生石灰吸水蒸馏除去酒精中的水,
故答案为:物质检验试剂除杂试剂甲烷(乙烯)酸性高锰酸钾溶液溴水酒精(水)无水硫酸铜新制的生石灰.
本题解析:
本题难度:简单
2、填空题 (12分).目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,写出在沉淀池的离子方程式??。
(2)操作A是?,操作B是??。
(3)加入的足量试剂a是??(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为??。
(5)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你? (填“同意”或“不同意”)此观点。
参考答案:Mg2+ + 2OH- ="=" Mg(OH)2↓?过滤?加热浓缩(或蒸发结晶)? HCl?
MgCl2(熔融)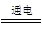 ?Mg + Cl2↑?不同意 ?Mg + Cl2↑?不同意
本题解析:(1)镁离子和OH-结合生成氢氧化镁沉淀,离子方程式为Mg2+ + 2OH- ="=" Mg(OH)2↓ 。
(2)氢氧化镁不溶于水,过滤即可。氯化镁易溶于水,要得到氯化镁晶体,需要加热浓缩(或蒸发结晶)。
(3)氢氧化镁和盐酸反应才能生成氯化镁,即a是氯化氢。
(4)镁是活泼的金属,需要通过电解法冶炼,方程式为MgCl2(熔融)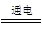 ?Mg + Cl2↑。 ?Mg + Cl2↑。
(5)氧化镁的熔点太高,熔合要消耗大量的能量,所以此观点是错误的,不同意。
本题难度:一般
3、选择题 下列各组物质中,X是主体物质,Y是少量杂质,Z是要除去杂质而加入的试剂,其中正确的组别是(? )
参考答案:B
本题解析:略
本题难度:简单
4、选择题 海水晒盐的原理(?)
A.利用热蒸发浓缩海水达饱和并进一步结晶
B.通过降温降低食盐的溶解度使食盐析出
C.利用加入沉淀剂的方法是食盐沉淀析出
D.利用泥沙使海水达到饱和,然后利用日光使食盐析出
参考答案:A
本题解析:由于食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用蒸发溶剂的方法。故选A。
本题难度:简单
5、填空题 海水中主要离子的含量如下:
成分
| 含量/(mg/L)
| 成分
| 含量/(mg/L)
| Cl-
| 18980
| Ca2+
| 400
| Na+
| 10560
| HCO3-
| 142
| SO42-
| 2560
| Mg2+
| 1272
|
?
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。
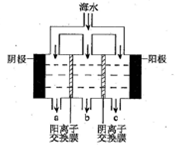
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
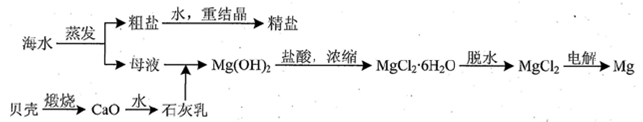
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。
参考答案:(1)HCO3-+H2O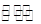 H2CO3+OH-(1分) H2CO3+OH-(1分)
(2)Mg(OH)2(1分),Ca2++ OH-十HCO3-→CaCO3↓+ H2O (2分)
(3)①过滤(1分),bd(l分)?②溶液表面形成晶膜(1分)
(4)①溶液变红(1分)?②盐酸(2分),-0.94(2分,没有负号不扣分).
本题解析:(1)常温下,海水的pH在7.5~8.6之间,其原因是存在碳酸氢根发生水解呈碱性。
(2)氢离子在阴极上产生氢气,此时阴极中集聚了大量氢氧根离子,并与镁离子生成Mg(OH)2白色沉淀,同时又和碳酸氢根生成碳酸根离子,碳酸根又和钙离子结合生成CaCO3,生成CaCO3的离子方程式是Ca2++ OH-十HCO3-→CaCO3↓+ H2O。
(3)①氯化钠的溶解度随温度变化不大,故蒸发的目的不是得到热饱和溶液,而是把水蒸出使晶体析出,最后应蒸发至有较多晶体析出时为止,选择bd。②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是溶液表面形成晶膜。
(4)①饱和Mg(OH)2溶液中滴加酚酞,由于溶液呈碱性,现象是溶液变红。②取一定体积的海水,加入足量盐酸除掉碳酸氢根,再加入足量NaOH,将Mg2+转为Mg(OH)2。由25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。求得1L溶液中镁离子的质量为5×10-4 *24=1200mg/L。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为(1200-1272)/1272=5.6%。
本题难度:一般
|