微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某原子的摩尔质量是Mg?mol-1,则一个该原子的真实质量是(?)
A.Mg
B.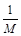 g
g
C.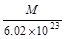 g
g
D.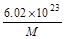 g
g
参考答案:C
本题解析:1mol该物质中含有NA的微粒,则一个该原子的真实质量是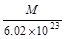 ,答案选C。
,答案选C。
点评:该题是基础性试题的考查,难度不大。主要是考查学生对阿伏加德罗常数的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于激发学生的学习兴趣和学习积极性。
本题难度:一般
2、选择题 取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是(?)
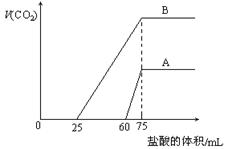
A.原NaOH溶液的物质的量浓度为0. 5mol/L
B.A线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3,NaHCO3
C.B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为: OH-+H+=H2O? H++CO32-=HCO3-
D.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL
参考答案:D
本题解析:观察图象,B曲线不产生气体需要盐酸的体积少于产生气体需要盐酸的体积,B曲线为Na2CO3和NaHCO3混合溶液,A曲线不产生气体需要盐酸的体积多于产生气体需要盐酸的体积,A曲线为Na2CO3和NaOH混合溶液。B错误。
B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为:H++CO32-=HCO3-,C错误;
无论A曲线或B曲线,当加入盐酸75mL时,产生二氧化碳气体体积最大,此时恰好完全反应,溶液中溶质为NaCl,Na+来自氢氧化钠,Cl-来自盐酸,n(Na+)=n(Cl-)=n(NaOH)=0.0075mol,所以每份溶液中c(NaOH)=0.75mol/L,A错误;
设B曲线溶液中Na2CO3物质的量为xmol,NaHCO3物质的量为ymol,
0→25发生反应:CO32-+H+=HCO3-
x?x?x
25→75发生反应:HCO3-+H+=H2O+CO2↑
x+y?x+y
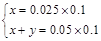 ?
?
n(CO2)=x+y=0.005mol,V(CO2)=112mL,D正确。
点评:氢氧化钠溶液中通入二氧化碳气体,按二氧化碳由少到多,所得溶液中溶质可能为:(1)NaOH+Na2CO3;(2)Na2CO3;(3)Na2CO3+NaHCO3;(4)NaHCO3。
本题难度:一般
3、实验题 (12分)某学生欲配制6.0mol/L的H2SO41000mL,实验室有三种不同浓度的硫酸:①480mL0.5mol/L的硫酸;②150mL25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._____________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响? (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意 。
参考答案:(1)3.0 (2)1000 (每空格各2分) (3)295 用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中 (4)偏小 (5)将稀释后的硫酸冷却到室温
本题解析:(1)根据c=1000ρω/M可知,25%的硫酸的物质的量浓度c=(1000×1.18g/mL×25%)÷98g/mol=3.0mol/L;
(2)要配制6.0mol/L的H2SO4 1 000mL,应选择1000ml的容量瓶;
(3)欲配制6.0mol/L的H2SO4 1000mL,所需硫酸的物质的量=6.0mol/L×1L=6.0mol。①480mL 0.5mol/L的硫酸中含硫酸的物质的量为0.5mol/L×0.48L=0.24mol;②150mL 25%的硫酸中含硫酸的物质的量为3.0mol/L×0.15L=0.45mol,6.0mol-0.24mol-0.45mol=5.31mol,所以需要18mol/L的硫酸的体积V=5.31mol÷18mol/L=0.2950L,即295.0ml;D、将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中后后续操作应该是用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
(4)根据c=n÷V,如果省略操作D,则溶质的物质的量n将会偏小,所配溶液的浓度将会偏小;
(5)容量瓶为精密仪器,物质在溶解或者稀释会放出大量的热,会损坏容量瓶,所以应将稀释后的硫酸冷却到室温后再转移。
考点:考查溶液浓度的计算和一定物质的量浓度溶液的配制
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的数值,下列说法正确的是
A.500 mL 2 mol·L-1 FeCl3溶液中Fe3+数为NA,且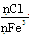 =3
=3
B.1 L pH=1的硫酸溶液中含有的H+为0.2NA
C.标准状况下,22.4L 乙烷中含极性共价键的数目为7NA
D.12 g石墨和C60的混合物中质子总数一定为6NA个