微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)实验室要用NaCl固体配制100mL 0.100mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,不会用到的是(?)
A.锥形瓶? B.250 mL 容量瓶? C.胶头滴管? D.100mL容量瓶? E.天平
(2)若要实施配制,除上述仪器外,尚缺的玻璃仪器或用品是_____________________。
(3)人们常将配制过程简述为以下各步骤:
A.冷却? B.称量? C.洗涤? D.定容? E.溶解? F.摇匀? G.转移溶液
其正确的操作顺序应是___________________?__(填各步骤序号)。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是(?)
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
参考答案:(8分)(1)A B?(2)烧杯、玻璃棒?(3)B E A G C D F?(4)B (每空2分)
本题解析:考查一定物质的量浓度溶液的配制及有关误差分析等。
(1)配制100ml溶液,需要100ml容量瓶。固体需要称量,溶解需要烧杯、玻璃棒,定容还需要胶头滴管,所以答案选AB。
(2)根据(1)中分析可知还缺少烧杯、玻璃棒。
(3)该哭配制的原理及要求可知,正确的操作顺序是B E A G C D F。
(4)根据c=n/V可知,定容时仰视容量瓶刻度线,则容量瓶中溶液的体积增加,浓度偏低;反之定容时俯视容量瓶刻度线,浓度偏高;将溶解冷却的溶液转入容量瓶后就直接转入定容操作,对实验是不影响的;定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,则容量瓶中溶液的体积增加,浓度偏低,实验答案选B。
本题难度:一般
2、选择题 下列溶液中Cl-的物质的量浓度最大的是( ?)
A.200mL 2mol/L MgCl2溶液
B.1000mL 2.5mol/L NaCl溶液
C.250mL 1mol/L AlCl3溶液
D.300mL 5mol/L KClO3溶液
参考答案:A
本题解析:溶液的浓度与溶液的体积多少无关;A中Cl-的物质的量浓度4 mol/L ;B中Cl-的物质的量浓度2.5;C中Cl-的物质的量浓度3 mol/L;D中Cl-的物质的量浓度为0,所以正确选项为A;
本题难度:一般
3、选择题 下列溶液中溶质的物质的量浓度为1mol/L的是
A.将40gNaOH固体溶于1L水中
B.将22.4L氯化氢气体溶于水配成1L溶液
C.将1L10mol/L的浓盐酸与9L水混合
D.10gNaOH固体溶解在水中配成250mL溶液
参考答案:D
本题解析:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液浓度为1mol?L-1,不是溶剂的体积为1L,故A错误;
B.22.4L氯化氢气体不是处于标准状况下不等于1mol,故B错误;
C. 1L10mol/L的浓盐酸与9L水混合由于二者密度不同,所以体积不等于二者体积和,C错误。
D. 10gNaOH固体溶解在水中配成250mL溶液,浓度等于10g?40g/mol?0.25L=1mol/L。正确。
点评:本题考查了有关物质的量浓度的问题,难度不大,注意气体与液体体积不能简单相加。
本题难度:一般
4、实验题 (各2.5分,共5分).取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016 L CO2(标况下),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。
参考答案:(5分)0.09mol (2.5分)? 0.01mol(2.5分)
本题解析:
Na2CO3+2HCl=2NaCl+CO2↑+H2O
1mol? 22.4L
n(Na2CO3)? 2.016L
Na2SO4+Ba(OH)2=BaSO4↓+2NaOH
1mol? 233g
n (Na2SO4)? 2.33g
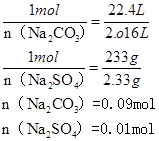
本题难度:简单
5、选择题 向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,剩余金属粉末的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比是 ( )
A.3︰2
B.1︰7
C.2︰7
D.1︰14
参考答案:D
本题解析:设H2SO4物质的量为x,CuSO4物质的量为y.
Fe+H2SO4=FeSO4+H2↑ 固体减少质量△m
1 mol ?56 g
x?56x
Fe+CuSO4=FeSO4+Cu 固体增加质量△m
56? 1mol ?64?8g
y?8y
充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,所以56x=8y,即x/y=1/7,
则原溶液中H+和SO42-的物质的量浓度之比=2x/(x+y)=1/4。故选D。
点评:本题考查了金属活动性顺序的应用以及根据反应的化学方程式的计算,完成此题,关键是抓住题干提供的剩余固体物质的质量与所加铁粉的质量相待,巧妙利用固体质量差量法进行计算。
本题难度:一般