微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。
请填写下列空白:
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制 1000mL溶液。除烧杯和玻璃棒外,还需要的玻璃仪器有_____、_____ 。
(2)滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到因加入一滴盐酸后,溶液由红色变为无色,并且半分钟内不恢复红色为止。
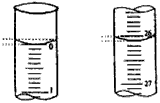
读数:若滴定开始和结束时,酸式滴定管中的液面如下图所示,则起始读数为____mL,终点读数_____
mL。
(3)数据处理:某学生根据三次实验分别记录有关数据如下
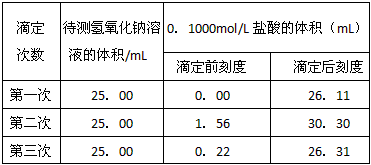
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=____________。
(4)误差讨论:(选填“偏高”、“偏低”或“无影响” )
①若酸式滴定管尖嘴部分滴定前无气泡,滴定终了有气泡,测得的氢氧化钠溶液的浓度将_____。
②若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将 _____。
参考答案:(1)胶头滴管;1000mL容量瓶
(2)0.00;26.10
(3)0.1044mol/L
(4)① 偏低;② 偏低
本题解析:
本题难度:一般
2、填空题 现有某一含2mol/L的Mg2+、2mol/L的Al3+的氯化镁和氯化铝溶液200ml.
(1)该溶液中Cl-物质的量浓度是______;要将溶液中Mg2+转化为沉淀完全分离,至少需加入2.4mol/L的氢氧化钠溶液______升.
(2)若要配制上述200ml的溶液,需要的玻璃仪器有______.
(3)人们常将配制过程简述如下:
①冷却;②洗涤烧杯中的液体;③称量;④溶解;⑤定容;⑥摇匀;⑦移液.
其正确的操作顺序是______.(填各步骤序号)
(4)若在滴加蒸馏水时,不慎超过了刻度线,应如何处理?______.
参考答案:(1)电荷守恒有c(Cl-)=2c(Mg2+)+3c(Al3+)=2×2mol/L+3×2mol/L=10mol/L,
将溶液中Mg2+转化为氢氧化镁沉淀完全分离,铝离子转化为偏铝酸根,此时氢氧化钠恰好反应需要体积最少,此时溶液中溶质为NaCl、NaAlO2,故n(NaOH)=n(NaCl)+n(NaAlO2)=10mol/L×0.2L+2mol×0.2L=2.4mol,故需要氢氧化钠溶液的最小体积为2.4mol2.4mol/L=1L,故答案为:10mol/L;1;
(2)实验室没有200mL容量瓶,以选择250mL容量瓶,还需要烧杯溶解药品,由玻璃棒搅拌、引流,
故答案为:250mL的容量瓶、烧杯、玻璃棒;
(3)溶液配制的演变步骤为:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等,正确的顺序为③④①⑦②⑤⑥,
故答案为:③④①⑦②⑤⑥;
(4)在滴加蒸馏水时,不慎超过了刻度线,应将溶液倒掉,洗涤容量瓶,重新配制,故答案为:将溶液倒掉,洗涤容量瓶,重新配制.
本题解析:
本题难度:一般
3、实验题 实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取盐酸体积________mL ,应选用容量瓶的规格_________mL。 除容量瓶外还需要的其它仪器___________________________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______________________
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3) 操作A中,将洗涤液都移入容量瓶,其目的是 __________________________________________ 溶液注入容量瓶前需恢复到室温,这是因为________________________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作___________ ;
b.加蒸馏水时不慎超过了刻度______________ ;
c.定容时俯视 _____________________________。
(5)若实验过程中出现如下情况如何处理? 加蒸馏水时不慎超过了刻度 ? ______________________
向容量瓶中转移溶液时(实验步骤B) 不慎有液滴掉在容量瓶外? ____________________________
参考答案:(1)2.1 ;250 ;量筒、烧杯、玻璃棒、胶头滴管
(2) BCAFED
(3)避免配制成的溶液浓度偏小; 容量瓶只能盛放室温下的溶液
(4)偏低 ;偏低 ;偏高
(5)重新配制 ;重新配制
本题解析:
本题难度:一般
4、填空题 1.有通常状况下的下列五种物质,请根据要求填写(填写序号):
(1)Cu(2)NO(3)NH3(4)NaHSO3(5)Fe(OH)3胶体
属于电解质的是______,能导致光化学烟雾的是______,与强酸和强碱都能发生非氧化还原反应的是______,能用浓硫酸干燥的气体是______,逐滴滴加稀盐酸至过量有先出现浑浊后变澄清现象的是______.
2.实验室用浓盐酸配制500mL、0.5mol?L-1的稀盐酸.试回答下列问题:
A.实验中除了玻璃棒、烧杯、量筒、胶头滴管外,还需要的玻璃仪器是______(填写仪器名称和规格),使用该仪器时,首先需要进行的检测是______.
B. 在配制过程中,若用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度将会______填“偏大”“偏小”或“无影响”之一).
参考答案:1.NaHSO3在水溶液和熔融状态下都能够导电的化合物,属于电解质;NO能够导致光化学烟雾;NaHSO3既能够与酸反应,也能够与碱溶液反应;浓硫酸为酸性干燥剂,不能干燥氨气,可以干燥NO;氢氧化铁胶体粒子带有电荷,加入盐酸后能够中和氢氧化铁胶粒所带电荷,胶体发生聚沉现象,生成氢氧化铁沉淀,之后再加入盐酸,氢氧化铁与盐酸反应,沉淀溶解,
故答案为:(4);(2);(4);(2);(5);
2.A.配制500mL溶液,需要选用500mL容量瓶;使用容量瓶前,必须检查容量瓶是否漏水,
故答案为:500ml容量瓶;检查仪器是否漏水;
B.在配制过程中,若用刚刚洗涤洁净的量筒来量取浓盐酸,会导致浓盐酸被稀释,量取的氯化氢的物质的量偏小,配制的溶液浓度偏低,
故答案为:偏小.
本题解析:
本题难度:一般
5、简答题 实验室用碳酸钠晶体(Na2CO3?10H2O)配制1.00mol/L的Na2CO3溶液240mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、量筒、______、______和胶头滴管;
(2)本实验须称量碳酸钠晶体(Na2CO3?10H2O)______g.
(3)容量瓶上标有刻度线、______、______.
(4)试分析下列操作,对所配溶液的浓度有何影响.
①若定容时俯视读数,会导致所配溶液浓度______.②若用未经干燥的容量瓶去配制溶液,会导致所配溶液浓度______.
参考答案:(1)配制实验所需实验步骤有称量、溶解、移液、洗涤、定容以及摇匀等操作,称量药品用托盘天平,加入到烧杯中溶解并用玻璃棒搅拌,冷却后用玻璃棒引流将液体转移到250ml容量瓶中,当溶液体积距离刻度线1~2cm时改用胶头滴管定容,故答案为:玻璃棒;250ml的容量瓶;
(2)实验室无240ml容量瓶,只能配制250ml溶液,配制1.00mol/L的Na2CO3溶液250mL,溶质的物质的量为1.00mol/L×0.25L=0.25mol,
质量为:0.25mol×286g/mol=71.5g,故答案为:71.5;
(3)容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,容量瓶上标有使用温度,容量瓶用来配制一定体积的溶液,不同的容量瓶有不同的使用规格,标有容积,
故答案为:温度;容积;
(4)①若定容时俯视读数,会导致所配溶液体积偏小,溶液浓度偏高;
②若用未经干燥的容量瓶去配制溶液,对实验结果无影响,
故答案为:偏高;无影响.
本题解析:
本题难度:一般