
参考答案:D
本题解析:略
本题难度:简单
2、实验题 草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O可用于摄影和蓝色印刷。实验室制备草酸合铁酸钾晶体的实验流程如下:
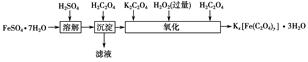
(1)若用铁和稀硫酸制备FeSO4·7H2O,常保持______过量,理由是___________________________________________________。
(2)上述流程中,“沉淀”一步所得FeC2O4·2H2O沉淀需用水洗涤。检验沉淀是否洗涤干净的方法是_________________________________________________________________。
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O42-含量的实验步骤如下:
步骤1:准确称取所制草酸合铁酸钾晶体a g(约1.5 g),配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入6 mol·L-1 HCl 10 mL,加热至70~80 ℃,趁热用SnCl2TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10 mL,在75~80 ℃下用0.010 00 mol·L-1 KMnO4标准溶液滴定至终点(Cl-不参与反应),将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积。
步骤3:……
步骤4:重复上述步骤2~步骤3两次。
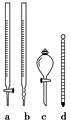
①步骤2操作时,还需要使用如图所示仪器中的________(填序号)。
②步骤2中MnSO4溶液的作用是________,滴定终点的现象是______________________________________。
③在不增加试剂种类的前提下,步骤3的目的是_________________________。
参考答案:(1)铁 防止Fe2+被氧气氧化
(2)取少量最后一次洗涤液,加入BaCl2溶液,若出现白色沉淀,说明沉淀没有洗涤干净,反之,沉淀已洗涤干净(其他合理答案也可)
(3)①ad ②作催化剂 溶液变为浅红色,且半分钟不褪色 ③测定C2O42-的含量
本题解析:(1)铁和稀硫酸制备FeSO4·7H2O,保持一种物质过量,主要是硫酸,因为在获得晶体的过程中抑制Fe2+的水解。(2)沉淀洗涤是否干净,主要是沉淀中所含的可溶性杂质是否存在,首先分析杂质可能是K2SO4,可以通过检验SO42-检验洗涤是否干净。(3)①注意测定过程中要控制温度,选择温度计,方法是通过利用KMnO4滴定,选用酸式滴定管。②滴定过程中MnO4-被还原为Mn2+,先加入Mn2+可能是作催化剂。滴定终点时,KMnO4过量,此时溶液呈浅红色,且半分钟内不褪色。③本实验的目的是测定Fe3+和C2O42-,而测定过程中,是先将Fe3+还原为Fe2+,然后利用KMnO4滴定氧化Fe2+、C2O42-,无法分别出Fe2+、C2O42-各自的量,只有总量,因此还需要滴定出Fe2+或C2O42-,由题可知滴定C2O42-更容易,因为可以另取溶液,直接滴定,因为此时铁为Fe3+不与KMnO4反应。
本题难度:一般
3、选择题 下列实验过程中产生的现象与对应的图形相符合的是
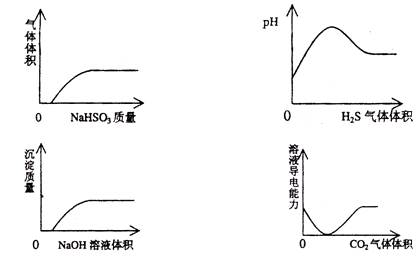
A.NaHSO3粉末加入HNO3溶液中
B.H2S气体通入氯水中
C.NaOH溶液滴入Ba(HCO3)2溶液中
D.CO2气体通入澄清石灰水中
参考答案:D
本题解析:略
本题难度:一般
4、实验题 某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。
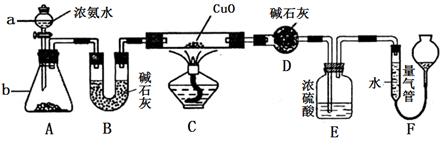
请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ →Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:?。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
参考答案:(1)分液漏斗?氧化钙或氢氧化钙或碱石灰
(2)还原? 3CuO + 2NH3 3Cu + N2↑+ 3H2O 3Cu + N2↑+ 3H2O
(3)吸收未反应的氨气,阻止F中水蒸气进入D
(4)将右侧的漏斗缓慢上下移动,使左右两管内液面相平,而且视线要平视。偏小?
(5)取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有
(6)9n / 11.2m
本题解析:(1)仪器a的名称分液漏斗。此题是实验室中常用浓氨水加热或将浓氨水滴加到固体氧化钙或氢氧化钙或碱石灰上,利用氧化钙或氢氧化钙的吸水性及溶解放热来促使氨气溢出。实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有还原性,相应的化学方程式3CuO + 2NH3 3Cu + N2↑+ 3H2O。 3Cu + N2↑+ 3H2O。
(3)E装置中浓硫酸的作用是吸收未反应的氨气,阻止F中水蒸气进入D。
(4)读取气体体积前,应对装置F进行的操作是:将右侧的漏斗缓慢上下移动,使左右两管内液面相平,而且视线要平视。若读数时,量气管中的液面低于水准管的液面,则量气管中气体的压强大于大气压强,这时量气管中气体的体积将偏小。
(5)检验该红色物质中是否含有Cu2O:取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有
(6)干燥管D增重mg,即吸收水蒸气的质量是mg,装置F测得气体的体积为nL,就是N2在标准状况体积是nL。n(H2O):n(N2)=(mg÷18g/mol):(nL÷22.4L/mol)="11.2m:9n." 则氨分子中氮、氢的原子个数比为(9n×2): (11.2m×2)= 9n/11.2m
本题难度:一般
5、填空题 某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验方案
| 实验现象
| ①将氯水滴加到溴化钠溶液中,振荡后加入适量CCl4溶液,振荡,静置
| A.浮在水面上,熔成小球,不定向移动,随之消失
| ②将一小块金属钠放入冷水中
| B.分层,上层无色,下层紫色
| ③将溴水滴加到NaI溶液中,振荡后,再加入适量CCl4,再振荡,静置
| C.浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失
| ④将一小块金属钾放入冷水中
| D.分层,上层无色,下层橙色
|
请你帮助该同学整理并完成实验报告。
(1)实验目的:_______________________________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液、CCl4等。
②仪器:________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):
实验方案
| 实验现象
| 化学方程式
| ①
| ?
| ?
| ②
| ?
| ?
| ③
| ?
| ?
| ④
| ?
| ?
|
(4)实验结论:________________________________________________________________________。
(5)请用原子结构的知识简单解释上述实验结论________________________________________________。
参考答案:(1)探究同主族元素性质的相似性和递变性? (2)试管 胶头滴管
(3)
实验方案
实验现象
化学方程式
①
D
Cl2+2NaBr===2NaCl+Br2
②
A
2Na+2H2O===2NaOH+H2↑
③
B
Br2+2NaI===2NaBr+I2
④
C
2K+2H2O===2KOH+H2↑
(4)同主族元素性质相似;自上而下元素原子失电子能力增强,得电子能力减弱
(5)由于同主族元素原子最外层电子数相同,所以同主族元素性质相似。又由于随着原子序数的递增,原子半径逐渐增大, 原子核对最外层电子的吸引力减弱,所以元素原子得电子能力减弱,失电子能力增强
本题解析:该实验目的是探究同主族元素性质的相似性和递变性。由于主族元素原子最外层电子数相同,所以性质相似;而随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的吸引力减弱,元素原子得电子能力减弱,失电子能力增强,所以同主族因素自上而下金属性逐渐增强,非金属性逐渐减弱,据此可以进行验证和探究。
点评:该题是基础性试题的考查,也是高考中的常见题型和考点。试题贴近高考,基础性强,难易适中,注重对学生能力的培养和基础知识的训练,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
|