微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式____________________________。
(2)甲同学设计的实验_______(填能或不能)验证乙炔与澳发生加成反应,其理由是_______(多选扣分)。
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是_______,它与溴水反应的化学方程式是_____________________;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。


(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是____________________________。
参考答案:(1)CaC2+2H2O→C2H2↑+Ca(OH)2、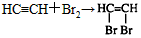 (或
(或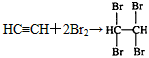 )
)
(2)不能;ac
(3)H2S;Br2+H2S=S↓+2HBr (4)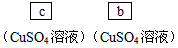 (5)如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。
(5)如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。
本题解析:
本题难度:一般
2、选择题 下列实验设计能完成预期实验目的的是
参考答案:C
本题解析:略
本题难度:一般
3、选择题 有关硫酸铜晶体里结晶水含量测定的实验,下列表述正确的是
A.将坩埚直接放在三角架上进行加热
B.坩埚在加热前未完全干燥,可使测定的结果偏低
C.加热温度过高,使一部分硫酸铜分解,可使测定结果偏高
D.实验步骤的顺序为:称量、研磨、加热、冷却、称量、再加热、冷却、称量
参考答案:C
本题解析:
正确答案:C
A.不正确,将坩埚放在泥三角上进行加热
B.不正确,坩埚在加热前未完全干燥,加热后坩埚可能破裂;
C.正确;
D.不正确,实验步骤的顺序为:研磨、称量(准确称量一干燥洁净的瓷坩锅质量)、再称(称量瓷坩埚+硫酸铜晶体的质量)、加热、冷却、称量、再加热、冷却、称量
本题难度:一般
4、实验题 研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)==Na2SO4+SO2↑+H2O,制备SO2气体。
①用简图(下图)在方框中画出制备并收集SO2的实验装置(含试剂)示意图。
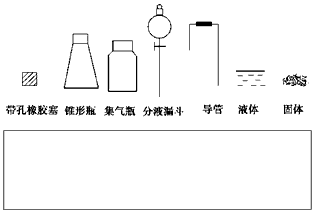
②实验过程中,使用分液漏斗滴加浓硫酸的操作是__________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是________________________;
②溴水溶液,现象是________________________;
③硫化钠溶液,现象是______________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因________________,验证方法____________________________。
②原因________________,验证方法____________________________。
③原因________________,验证方法____________________________。
参考答案:(1)① ②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加
(2)①溶液褪色;②溶液褪色;③有浅黄色沉淀生成(或溶液变浑浊)
(3)①Na2SO3变质;取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,有白色沉淀生成,则证明该Na2SO3固体变质
②所用硫酸不是浓硫酸 用干燥洁净的玻璃棒蘸取待测试样,涂在白纸上,白纸不变黑,则证明该溶液不是浓硫酸
本题解析:
本题难度:一般
5、实验题 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
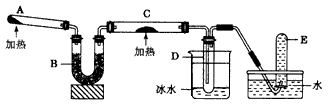
回答下列问题:
(1)A中加入的物质是___,发生反应的化学方程式是____。
(2)B中加入的物质是___,其作用是____。
(3)实验时在C中观察到的现象是____,发生反应的化学方程式是____。
(4)实验时在D中观察到的现象是____, D中收集到的物质是___,检验该物质的方法和现象是____ 。
参考答案:(1)固体NH4 Cl和Ca(OH)2 ;2NHCl+Ca(OH)2 CaCl2+2NH3↑+2H2O(其他合理答案也可)。
CaCl2+2NH3↑+2H2O(其他合理答案也可)。
(2)碱石灰(或CaO) 除去NH3气流中的水蒸气
(3)黑色粉末部分逐渐变为色 ;2NH3 +3CuO N2+3H2O+3Cu
N2+3H2O+3Cu
(4)出现无色液体 ;氨水 ;用红色石蕊试纸检验,试纸变蓝或用无水硫酸铜检验,无水硫酸铜变蓝
本题解析:
本题难度:一般