微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列溶液中,BaSO4的溶解度最大的是( )
A.1?mol/L?H2SO4溶液
B.2?mol/L?Na2SO4溶液
C.0.1?mol/L?BaCl2溶液
D.纯水
2、选择题 下列化学实验事实及其解释都正确的是
[? ]
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
C.向0.l moI/LFeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
D.向2.0 mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加l-2滴0.01mol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比Agl的Ksp大
3、简答题 (15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:

(1)加6%的H2O2时,温度不能太高,其目的是?。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况?。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH=?。
(3)流程中加入NH4F的目的是?。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式?。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式?;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是?。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6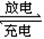 ?LaNi5+6Ni(OH)2。该电池放电时,负极反应是?。
?LaNi5+6Ni(OH)2。该电池放电时,负极反应是?。
4、选择题 NaHSO4溶于水的过程中,发生了变化的化学键有?(?)
A.既有离子键、又有共价键
B.共价键
C.离子键
D.化学键未发生变化
5、填空题 (12分)海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
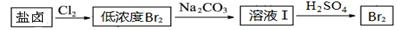
将Br2与Na2CO3反应的化学方程式补充完整:
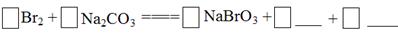
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
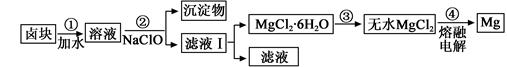
生成氢氧化物沉淀的pH
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Fe(OH)2
| 7.6
| 9.6
|
Mn(OH)2
| 8.3
| 9.8
|
Mg(OH) 2
| 9.6
| 11.1
|
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
④步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
③NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。