微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
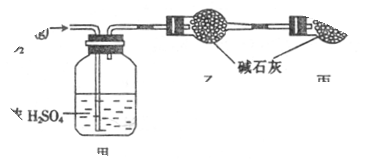
1、填空题 (6分)已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收)。
?
| 实验前
| 实验后
|
甲的质量 / g
| 101.1
| 103.8
|
乙的质量 / g
| 82.0
| 86.4
|
根据实验数据填空:
(1)该燃料分子中碳、氢原子的数目比为 。
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为?
参考答案: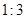 ;C2H6O
;C2H6O
本题解析:(1)我们知道浓硫酸可以用来吸收水蒸气,因为假设生成的气体全部被吸收,故甲装置增加的质量为H2O的质量,即m(H2O)=103.8-101.1=2.7g,H的质量=2.7g*(2/18)=0.3g,而碱石灰可以用来吸收CO2,故乙装置增加的质量为CO2的质量,即m(CO2)=86.4-82.0=4.4g,C的质量=4.4g*(12/44)=1.2g,故碳、氢原子的数目比为(1.2/12):(0.3/1)=1:3。
(2)设该分子含有n个碳原子,则氢原子为3n个,分子质量为12n+3n+16=46,即n=2,所以表明该分子有2个碳原子,6个氢原子和一个氧原子,故该物质为C2H6O。
点评:本题通过理解判断各吸收剂所吸收的物质来计算分析C、H的质量,属于中等难度的题,要求学生掌握常见的干燥剂、吸收剂。
本题难度:一般
2、实验题 某化学兴趣小组在学习“硫酸盐的某些性质和用途”中,进行了如下实验探究:
【实验一】检验(NH4)2Fe(SO4)2·6H2O溶液中含有的阳离子。
(1)在下表中写出操作步骤和实验现象:
限选试剂:新制氯水、1mol/LH2SO4溶液、0.1mol/L KSCN溶液、NaOH浓溶液、浓盐酸、1mol/LNa2CO3溶液
操 作 步 骤
| 实验现象
| 结 论
|
步骤I:取少量待检液于试管中,?
?。
| ?
?
| 溶液中含有Fe2+
|
步骤II:取少量待检液于试管中,?
?。
| ?
?
| 溶液中含有NH4+
|
?
【实验二】用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用电解KHSO4饱和溶液可制取一定浓度的H2O2。兴趣小组进行下列实验测定H2O2的质量分数。已知:2MnO4-+5H2O2+6H+= 2Mn2++8H2O+5O2↑
操作①:取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.1000 mol/L KMnO4溶液滴定;
操作③:用同样方法滴定,四次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、22.00 mL。
回答下列问题:
(2)操作②中,开始滴入KMnO4溶液时反应速率很慢,随着KMnO4溶液滴入反应速率显著加快,最有可能的原因______________________。
(3)滴定时盛装KMnO4溶液应选取的仪器是?(填序号)。
A.50mL酸式滴定管 ? B.50mL碱式滴定管
C.25mL酸式滴定管 ? D.25mL碱式滴定管
(4)在上述实验中,下列操作会造成测定结果偏高的有?(填序号)。
A.锥形瓶用待测液润洗
B.量取 H2O2溶液的滴定管用蒸馏水洗净,未用H2O2溶液润洗?
C.滴定速度过快,又未摇匀,停止滴定后发现紫红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(5)分析数据,计算H2O2溶液中溶质的质量百分含量为___________(保留三位有效数字)。
参考答案:(共17分)
(1)(每空2分,共8分)
操作步骤
实验现象
先滴加几滴0.1mol/L KSCN溶液,再滴加适量的新制氯水,振荡
开始时无明显现象;然后溶液呈(血)红色?
滴加适量的NaOH浓溶液,加热,将蘸有浓盐酸的玻璃棒靠近试管口。
?(溶液中产生气泡,管口) 产生白烟
?
(2)反应中生成的 Mn2+具有催化作用? (2分)?
(3)C? (2分);?(4) AD? (2分);?(5)3.40% (3分)
本题解析:(1)从题给试剂和铁离子、亚铁离子的性质设计步骤I的方案,亚铁离子具有还原性,遇KSCN溶液不变红,新制氯水可以将亚铁离子氧化,生成的铁离子遇KSCN溶液变红,因此取少量待测溶液于试管中,先滴加几滴0.1mol/L KSCN溶液,再滴加适量的新制氯水,振荡,开始时无明显现象,然后溶液呈红色,说明溶液中含有Fe2+;根据铵根离子的性质设计步骤II的方案,铵根离子与强碱溶液混合加热时生成氨气,氨气与氯化氢气体混合时产生大量的白烟,氨气可用蘸有浓盐酸的玻璃棒检验,因此取少量待测溶液于试管中,滴加适量NaOH浓溶液,加热,将蘸有浓盐酸的玻璃棒靠近试管口,若溶液中产生气泡、管口产生白烟,说明溶液中含有NH4+;(2)根据外界条件对反应速率的影响规律,刚滴定时浓度最大,反应速率慢,说明不能用浓度、压强解释,由于该反应的反应热未知,也不宜用温度解释,排除之后只有用催化剂解释反应速率先慢后快的原因,即反应中生成的 Mn2+具有催化作用;(3)酸性高锰酸钾溶液具有腐蚀橡胶中碳碳双键的性质,因此只能用酸式滴定管盛装高锰酸钾溶液,由于每次滴定都消耗20mL酸性高锰酸钾溶液,25mL规格的酸式滴定管最接近20mL,可以减少误差,因此C选项正确;(4)锥形瓶用待测液润洗,就会使消耗的酸性高锰酸钾溶液体积增大,导致测定结果偏大,故A选项错正确;量取双氧水的滴定管未润洗,其中的蒸馏水能稀释加入的双氧水,就会使消耗的酸性高锰酸钾溶液体积减小,导致测定结果偏低,故B选项错误;滴定速率过快,未摇匀,停止滴定后紫红色褪去,说明消耗高锰酸钾溶液偏少,导致测定结果偏低,故C选项错误;滴定管上小刻度在上,大刻度在下,二者之差就是消耗标准酸性高锰酸钾溶液的体积,若前读数正确,仰视导致后读数偏大,就会使消耗酸性高锰酸钾溶液体积增大,导致测定结果偏高,故D选项正确;(5)先处理酸性高锰酸钾溶液体积的数据,将异常数据(22.00mL)舍去;再用正常数据求酸性高锰酸钾溶液的平均体积,即(20.00+19.98+20.02)mL/3=20.00mL;然后计算每次滴定消耗高锰酸钾或高锰酸根离子的物质的量,即n(MnO4-)=c?V=0.1000mol/L×20.00×10—3L;由于反应2MnO4-+5H2O2+6H+= 2Mn2++8H2O+5O2↑中过氧化氢与高锰酸根离子的系数之比等于物质的量之比,则5.00mL待测液中n(H2O2)=5n(MnO4-)/2=0.1000mol/L×20.00×10—3L×5/2;接着根据m=n?M求过氧化氢的质量、m=ρ?V 求双氧水溶液的质量,即前者为0.1000mol/L×20.00×10—3L×5/2×34g/mol,后者为1.00g/mL×5.00mL;最后根据溶质的质量除以溶液的质量求溶质的质量分数,即(0.1000mol/L×20.00×10—3L×5/2×34g/mol)/(1.00g/mL×5.00mL)×100%=3.40%(保留三位有效数字)。
本题难度:一般
3、实验题 为了达到下 表所列的实验目的,请选择合适的实验方法,将其标号填在答题上。
表所列的实验目的,请选择合适的实验方法,将其标号填在答题上。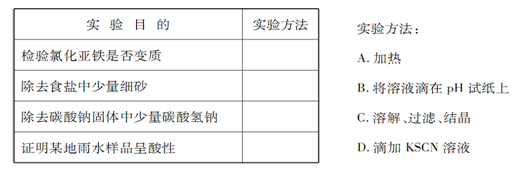
参考答案:(4分)?D ?C ?A?B
本题解析:略
本题难度:一般
4、实验题 化学兴趣小组在实验中发现:将锌粒放入CuSO4溶液中一段时间,锌粒表面附着了一层松散的黑色粉末状物质,而不是预期的红色物质。通过查阅资料和讨论,大家认为黑色物质可能由Cu、CuO和Zn组成。同学们决定对黑色物质进行探究。
Ⅰ.小组成员认为黑色物质中含有氧化铜,是反应过程中生成了Cu(OH)2分解产生的。请说明反应过程中产生Cu(OH)2的原因:_________________。
Ⅱ.兴趣小组对黑色粉末状物质的组成进行了实验探究。请完成下列实验报告限选实验仪器与试剂:
1 g黑色粉末、试管、玻璃棒、药匙、滴管、酒精灯、试管夹、稀H2SO4、 浓HNO3、稀NaOH溶液、蒸馏水
实验报告
(1)实验课题:探究黑色粉末的组成
(2)设计实验方案
(3)实验过程

(4)实验讨论:根据以上探究结果,如果要在锌与CuSO4溶液的反应中获得预期的红色物质,改进的方法是__________________。
参考答案:ⅠCu2++2H2O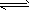 Cu(OH)2+2H+,加入金属锌,与H+反应,降低H+浓度,使平衡向正方向移动,生成
Cu(OH)2+2H+,加入金属锌,与H+反应,降低H+浓度,使平衡向正方向移动,生成
Cu(OH)2沉淀Ⅱ.(3) (4)往CuSO4溶液中加入适量稀硫酸使溶液呈酸性,抑制Cu2+水解
(4)往CuSO4溶液中加入适量稀硫酸使溶液呈酸性,抑制Cu2+水解
本题解析:
本题难度:一般
5、填空题 如图甲所示,某同学将一小块钠放在石棉网上加热,观察到生成的产物除了淡黄色固体外还有一些黑色固体物质,当时他想这种黑色物质应该是钠表面吸附的煤油不完全燃烧产生的碳单质,但在学习了镁与C02的反应后,该同学想:就金属活动性而言,Na比Mg还强,该黑色物质是否是Na与C02反应生成的碳单质。为了验证自己的想法,该同学利用装置乙进行实验。
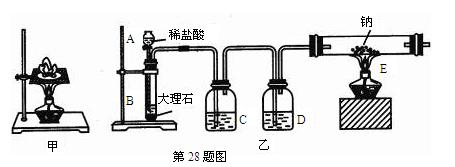
实验步骤如下:①切取一小块金属钠,用滤纸完全吸干煤油,再除去表面的氧化层,放进干燥的E中;
②打开分液漏斗的活塞,使B中的反应进行一段时间后,再点燃E处的酒精灯。
实验现象如下:钠在充满C02气体的玻璃管中剧烈燃烧起来,产生大量的白烟;玻璃管中有黑色物质生成;待玻璃管冷却后,管壁上附着一层白色物质。
请回答下列问题:
(1)C中盛放的试剂是?,作用是?。D中盛放的试剂是?,作用是?。
(2)B中的反应进行一段时间后,再点燃E处的酒精灯的目的是?。
(3)该同学将白色物质和黑色物质分别溶于水,发现黑色物质不溶于水,白色物质能溶于水。由此,该同学得出结论,该黑色物质是Na与C02反应生成的碳单质,则其他生成物还应该有?。
(4)请设计一实验方案验证玻璃管内Na与C02反应生成的白色物质的成分,并写出实验步骤、现象和结论?。
(5)若先点燃E处的酒精灯,再打开分液漏斗的活塞,写出此时玻璃管E中可能发生的反应的化学方程式?。
参考答案:(1)饱和NaHC03溶液?除去C02中的HCl气体?浓硫酸?除去C02中的水蒸气
(2)用C02排尽装置内空气?
(3)Na2 C03?
(4)取少量白色固体于试管 中,加入稀盐酸,如果产生无色无味
中,加入稀盐酸,如果产生无色无味 能使石灰水变浑浊的气体,则证明白色固体是碳酸钠?
能使石灰水变浑浊的气体,则证明白色固体是碳酸钠? ?
?
(5)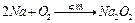
本题解析:略
本题难度:一般