微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
 2SO2 (g) + O2 (g) ?2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是?(?)
2SO2 (g) + O2 (g) ?2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是?(?)
A.4molSO2和2molO2
B.5molSO2和3molO2
C.4molSO2和4molO2
D.2molSO2、1molO2和2molSO3
参考答案:B
本题解析:本题的实质是热化学方程式及焓变的意义理解。在热化学方程式中,△H表示完全燃烧2 molSO2时放出的热量,要想得到2a kJ热量,必须加入过量SO2和O2,故选B。学生做题时很容易当成一个等效平衡题来分析,则可能会找不到思路。
本题难度:一般
2、填空题 (10分)一氧化碳是一种重要的化工原料。
(1)高炉炼铁中发生的反应之一是:

 FeO(s)+CO(g) ?Fe(s)+CO2(g)?△H=-1kJ/mol。
FeO(s)+CO(g) ?Fe(s)+CO2(g)?△H=-1kJ/mol。
温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将?
(填“增大”、“减小”或“不变”)。
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应??.
A.向正反应向向进行? B.处于平衡状态? C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去。在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:
 CO(g)+H2O(g)? CO2(g)+H2(g)? K=1.0
CO(g)+H2O(g)? CO2(g)+H2(g)? K=1.0
若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为??。
(3)用CO和H2经如下两步反应制得甲酸甲醛:
CO+2H2→CH3OH
CO+CH3OH→HCOOCH2
已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52;CO最多可制得甲酸甲醛多少吨?(写出计算过程)。
参考答案:(10分)
(1)减小(2分)? A(2分)
(2)50.0%(2分)
(3)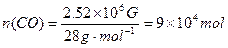
设用于制备的CO的物质的量为x,用于和甲醇反应的CO的物质的量为y
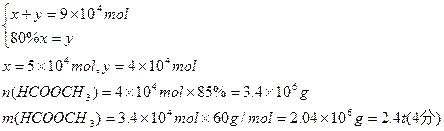
本题解析:略
本题难度:一般
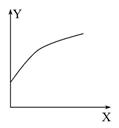
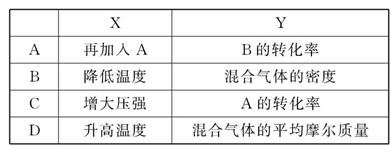
3、选择题 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g) 2C(g)?ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是(? )
2C(g)?ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是(? )
参考答案:D
本题解析:增加A气体的物质的量,平衡向正反应方向移动,B的转化率增大,A对;降低温度,平衡向正反应方向移动,混合气体的体积减小,容器的体积减小,混合气体的总质量不变,混合气体的密度增大,B对;增大压强平衡向正反应方向移动,A的转化率增大,C对;升高温度,平衡向逆反应方向移动,混合气体的总物质的量增大,总质量不变,混合气体的平均摩尔质量减小,D错。
本题难度:一般
4、选择题 一定温度下,H2(g)+CO2(g)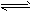 H2O(g) +CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
H2O(g) +CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是

[? ]
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
参考答案:C
本题解析:
本题难度:一般
5、填空题 (10分)甲醇(CH3OH)的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上用3克氢气与二氧化碳反应生成气态甲醇和水蒸气,放出24.5千焦的热量。
①请写出该反应的热化学反应方程式:?利用该反应,在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:?
②从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为?。
③A中达到平衡时CO2的转化率为?, B中a=?。
(2)某同学设计了一个甲醇燃料电池,其装置如图:
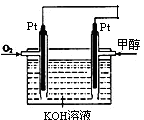
①写出图中通入甲醇这一极的电极反应式?。
②反应一段时间后,正极附近的碱性?(增强。减弱?不变)
参考答案:(1)①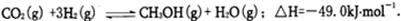 ? (2分)
? (2分)
② 0.1c1 mol/(L·s) 或0.1c2 mol/(L·S)(任答对一个得分)(1分)
③ 60%? (2分)?19.6(2分)
(2)① CH3OH - 6e-+ 8OH- = CO32-+ 6H2O? (2分)?② 增强(1分)
本题解析:(1)①考查热化学方程式的书写②甲醇的浓度变化未c1,则根据方程式可知,CO2的浓度变化也是c1,所以反应速率为0.1c1 mol/(L·s)。放出的热量是29.4kJ,所以消耗的CO2是 ,所以转化率是60%。根据反应物投入量可知A和B是等效的,所以B中吸收的热量是49kJ-29.4kJ=19.6kJ。
,所以转化率是60%。根据反应物投入量可知A和B是等效的,所以B中吸收的热量是49kJ-29.4kJ=19.6kJ。
(3)甲醇失去电子,发生氧化反应,在负极通入。氧气在正极通入,得到电子发生还原反应,生成OH-,所以正极周围碱性增强。
本题难度:一般