微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
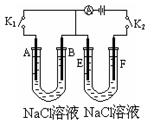
(1)打开K2,合并K1。B为?极,A的电极反应为?,最终可观察到的现象是?
涉及的化学反应方程式有:?
(2)打开K1,合并K2。E为?极,F极的电极反应?为?,检验F极产生气体的方法是?。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是?,原因是?
2、填空题 (18分)氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为: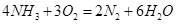 。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
a.电能全部转化为化学能
b.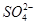 的物质的量浓度不变(不考虑溶液体积变化)
的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液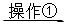 白色沉淀
白色沉淀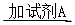 观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
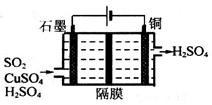
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu。写出装置中阳极的电极反应式__________。
(3)已知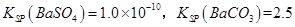
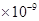 。某同学设想用下列流程得到BaCl2,
。某同学设想用下列流程得到BaCl2,
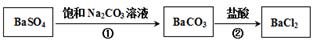
则①的离子方程式为_________,该反应的平衡常数K=__________;
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液,发生 反应
反应
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:
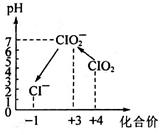
请回答:
①确定操作Ⅱ完全反应的现象是___________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________。
3、填空题 “电解二氧化锰”是电池工业中的一种重要原料,具有很强的催化氧化、离子交换和吸附能力。
(1)工业上常用电解硫酸和硫酸锰的混合溶液的方法来制备“电解二氧化锰”,装置如图所示。则

①MnO2在_______极生成。
②阴极的电极反应式为______________。
(2)Zn-MnO2干电池应用广泛,该电池的负极材料是_______,电池工作时,电子流向_______(填“正极”或“负极”)。
(3)将MnO2置于氨气流中,加热能得到黑色固体Mn2O3,同时还有一种气体单质生成。
①该反应的化学方程式为______________。
②若将上述反应设计成原电池,则在负极发生反应的物质是_______。
4、选择题 下列图示与对应的叙述一定正确的是(?)
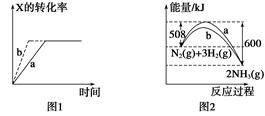
A.图1所示,反应:X(g)+2Y(g)  3Z(g),b的压强一定比a大
3Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
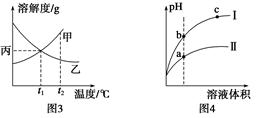
C.图3所示,t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等
D.图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
5、填空题 (10分)
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为_______________。要清洗附着在试管壁上的硫,可用的试剂是________。

(2)如图所示为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx,负极的电极反应式为________,正极的电极反应式为________。M(由Na2O和Al2O3制得)的两个作用是________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。(Pb的相对原子质量为 207)
(3)Na2S溶液水解的化学方程式?。溶液中离子浓度由大到小的顺序为_______,向该溶液中加入少量固体CuSO4,溶液pH________(填“增大”“减小”或“不变”)。