微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法不正确的是
[? ]
A.H2SO4氧化性大于MnO2
B.①中析出16g S时转移l mol电子
C.②反应电解时阴极上Zn2+先放电
D.硫酸在该生产中可循环利用
参考答案:B
本题解析:
本题难度:简单
2、填空题 (15分)
(1)已知:
甲醇制烯烃反应①:2CH3OH(g)=C2H4 (g)+2H2O(g)?△H1=-29.0 KJ·mol-1
甲醇脱水反应②:2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H2=-24.0 KJ·mol-1
乙醇异构化反应③:CH3CH2OH(g)=CH3OCH3(g))?△H3=+50.8 KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H= KJ·mol-1
(2)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ、通入氨,冷却、加食盐,过滤;Ⅱ、不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是 。而方法Ⅱ的优点是其滤液可以 。
(3)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 :PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式 ,电解液中加入Cu(NO3)2的原因是 。
参考答案:(14分) (1)-45.8
(2) ①NH4HCO3+NaCl→NaHCO3↓+NH4Cl ②母液中含有氯化铵,通入氨,冷却、加食盐,有利于氯化铵的析出;直接循环使用
(3)PbO+ClO-= PbO2+Cl- Pb2++2H2O-2e- = PbO2↓+ 4H+
如果不加入硝酸铜,阴极会发生Pb2++2e- ="Pb↓" 不能有效利用Pb2+,使Pb2+的利用率降低。
本题解析:(1)根据盖斯定律,②-①-③可得所求热化学方程式,则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=②-①-③=(-24.0+29-50.8)kJ/mol=-45.8kJ/mol;
(2)①根据物质溶解度的不同,氯化钠的溶解度大于碳酸氢钠的溶解度,所以向饱和的氯化钠溶液中加入碳酸氢铵,则生成碳酸氢钠沉淀和氯化铵,化学方程式是NH4HCO3+NaCl→NaHCO3↓+NH4Cl;
②I与II的区别在于是否通入氨气,而通入氨气,则氯化铵的浓度增大,加入食盐后,发生盐析,有利于氯化铵的析出;而方法I过滤后的溶液中含有氨气,所以不能循环使用,方法II过滤后的溶液为氯化钠,可直接循环使用;
(3)PbO与次氯酸钠反应生成PbO2,Pb元素的化合价升高,则Cl元素的化合价降低,所以次氯酸根离子被还原为氯离子,离子方程式是PbO+ClO-= PbO2+Cl-;电解时,阳极发生氧化反应,因为该电解池可制取PbO2,所以阳极是Pb2+失去电子与水结合生成PbO2,电极反应式是Pb2++2H2O-2e- = PbO2↓+ 4H+;若不加入硝酸铜,则阴极是阳离子放电,则在阴极放电的是Pb2+,生成Pb,所以阳极上得到PbO2的量将减少,Pb2+的利用率降低。
考点:考查盖斯定律的应用,对实验方案的分析,电化学反应原理的应用
本题难度:困难
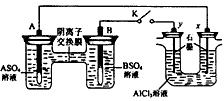
3、选择题 某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处SO42-从右向左移动。下列分析正确的是
[? ]
A.溶液中(A2+)浓度减小
B.B的电极反应:B-2e-==B2+
C.y电极上有H2产生,发生还原反应
D.反应初期,x 电极周围出现白色胶状沉淀,不久沉淀溶解
参考答案:D
本题解析:
本题难度:一般
4、选择题 如图用石墨作电极的电解池中,放入某足量蓝色溶液500mL进行电解,观察到A电极表面有红色固体生成,B电极有无色气体生成;通电一段时间后,取出A电极,洗涤、干燥、称量,A电极增重1.6g。下列说法错误的是
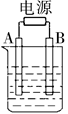
A.图中B极同电源正极相连
B.该蓝色溶液可能是Cu(NO3)2或CuCl2溶液[
C.电解后溶液的pH约为 1(溶液体积变化忽略不计)
D.要使电解后溶液恢复到电解前的状态,则可加入2 g CuO
参考答案:B
本题解析:根据现象判断蓝色溶液可为硫酸铜或硝酸铜溶液,A、电解时铜在阴极析出,氧气在阳极产生,B与电源的正极相连,正确;B、若电解CuCl2溶液阳极产生黄绿色气体,错误;C、根据电荷守恒,析出铜单质,氢离子补充,n(H+)="2" n(Cu2+)=2×1.6÷64=0.05mol,c(H+)=0.1mol/L,正确;D、电解时产生铜和氧气,加入n(CuO)= 1.6÷64×80=2g,正确。
本题难度:一般
5、填空题 工业上利用铬铁矿(FeO Cr2O3)冶炼铬的工艺流程如下:
Cr2O3)冶炼铬的工艺流程如下:
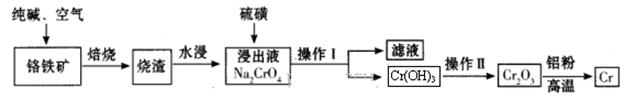
(1)实验室焙烧铬铁矿可选用的装置是__________(填序号)。
(2)完成下列化学方程式(在横线上填写物质的化学式及计量数):4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+_____________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:__________________。
(4)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3溶于浓氢氧化钠溶液的离子方程式________________________________。
(5)由Cr2O3冶炼Cr的化学方程式为____________________________。
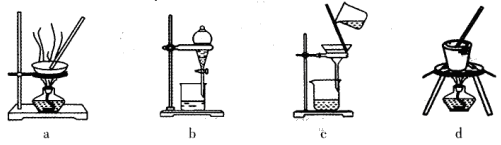
(6)目前有一种采用以铬酸钠(Na2CrO4)为原料,用电化学法制备重铬酸钠(Na2Cr2O7)的实验装置如下图所示(已知:2CrO42-+2H+ Cr2O72-+H2O)。
Cr2O72-+H2O)。

①写出阴极的电极反应式为________________________________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则此时铬酸钠的转化率为___。
参考答案:(1)d (2分,大写字母不得分)?(2)2OH- (2分,计量数写错、化学式写错均不得分)
(3)将蒸馏水沿玻璃棒慢慢倒入漏斗中浸没沉淀(1分),待水流尽后,再重复操作2~3次(1分)? (共2分,合理答案即可)
(4)Cr(OH)3 + OH- = CrO2- + 2H2O (2分,化学式写错、不配平均不得分,写化学方程式不得分)
(5)Cr2O3 + 2Al 2Cr + Al2O3?(2分,不写反应条件不扣分,化学式写错、不配平不得分)
2Cr + Al2O3?(2分,不写反应条件不扣分,化学式写错、不配平不得分)
(6)①2H+ + 2e- = H2↑(或2H2O+2e-=2OH-+H2↑)(2分,化学式写错、不配平均不得分)(2分)
②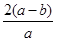 ×100% (2分,合理答案即可)
×100% (2分,合理答案即可)
本题解析:(1)固体灼烧需要在巩固中完成,根据装置图可知,a、b、c分别是蒸发、分液与过滤,d装置是坩埚,因此实验室焙烧铬铁矿可选用的装置是d。
(2)根据电荷守恒可知,该生成物是带负电荷的。根据原子守恒可知,该微粒石油氢原子和氧原子组成的,所以应该是OH-,计量数是2。
(3)过滤后得到的沉淀必须在过滤器中完成,所以实验室中洗涤沉淀的操作将蒸馏水沿玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次;
(4)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,因此Cr(OH)3溶于浓氢氧化钠溶液反应生成的是NaCrO2和水,反应的离子方程式为Cr(OH)3 + OH- = CrO2- + 2H2O。
(5)Cr的冶炼一般是通过铝热反应,所以由Cr2O3冶炼Cr的化学方程式为Cr2O3 + 2Al 2Cr + Al2O3。
2Cr + Al2O3。
(6)①电解池中阴极得到电子,发生还原反应。所以惰性电极电解铬酸钠溶液时阴极是溶液中的氢离子放电,反应的电极反应式为2H+ + 2e- = H2↑。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol。所以根据电荷守恒可知,阴极区生成氢氧化钠的物质的量是(a-b)mol,属于消耗氢离子的物质的量是(a-b)mol,所以根据方程式2CrO42-+2H+ Cr2O72-+H2O可知,消耗铬酸钠的物质的量是(a-b)mol。反应前铬酸钠的物质的量是0.5amol,所以铬酸钠的转化率是
Cr2O72-+H2O可知,消耗铬酸钠的物质的量是(a-b)mol。反应前铬酸钠的物质的量是0.5amol,所以铬酸钠的转化率是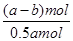 ×100%=
×100%=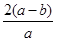 ×100%。
×100%。
本题难度:困难