微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
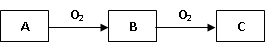
(1)若A是一种黄色单质固体,则B→C的化学方程式为?。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为?,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理?。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为?,C为?,(填写化学式)
实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式:??。
②写出C与水反应的化学方程式:??。
参考答案:(11分)(1)2SO2+O2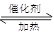 2SO3(2分)
2SO3(2分)
(2)过氧化钠(1分)? 2Na2O2+2CO2==2Na2CO3+O2(2分)
(3)① A: NH3,(1分)? C: NO2.(1分)
2NH4Cl+? Ca (OH) 2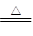 ?CaCl2 +2NH3↑+2H2O (2分)
?CaCl2 +2NH3↑+2H2O (2分)
② 3 NO2+ H2O= 2HNO3+ NO (2分)
本题解析:(1)若A是一种黄色单质固体,则A是S单质,属于B是二氧化硫,C是三氧化硫,则B→C的化学方程式为2SO2+O2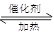 2SO3。
2SO3。
(2)若A是一种活泼金属,C是淡黄色固体,则A是钠,B是氧化钠,C是过氧化钠。过氧化钠能吸收CO2生成氧气,反应的化学方程式是2Na2O2+2CO2==2Na2CO3+O2。
(3)①若A为能使湿润的红色石蕊试纸变蓝的气体,则A应该是氨气。C是红棕色气体,且B和C易在空气形成光化学烟雾,这说明B是NO,C是NO2。实验室制取氨气的化学方程式是2NH4Cl+? Ca (OH) 2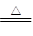 ?CaCl2 +2NH3↑+2H2O。
?CaCl2 +2NH3↑+2H2O。
②NO2与水反应的化学方程式是3 NO2+ H2O= 2HNO3+ NO。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础知识,侧重对学生基础知识的巩固个训练。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、填空题 A、B、C、D、E是中学常见的几种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
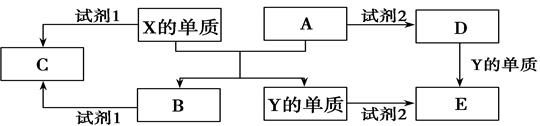
回答下列问题:
(1)X的单质与A反应的化学方程式是________________________________。
(2)若C溶液显碱性,则试剂1是? ____溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示)?。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是?;
②写出D→E反应的离子方程式?;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是:?。
参考答案:(1)2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
(2)NaOH(或OH-) Al3++3H2O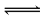 Al(OH)3+3H+
Al(OH)3+3H+
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色;则证明原溶液含有Fe3+
②2Fe3++Fe=3Fe2+?③2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
本题解析:元素X、Y的单质是生活中常见的金属,Y的用量最大,则X为Al,Y为Fe,A、B是氧化物,则Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,若C溶液显碱性,则试剂1为NaOH溶液时,C为偏铝酸钠;若C溶液为酸性,C为强酸对应的铝盐,试剂2为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂1为硫酸时,C为硫酸铝,该溶液水解显酸性,
(1)X的单质与A反应为铝热反应,即Al与氧化铁反应生成氧化铝和Fe,该反应为Fe2O3+2Al
Al2O3+2Fe,
(2)若C溶液为碱性,试剂1是NaOH溶液,①Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;若C溶液显酸性,则显酸性的原因是Al3++3H2O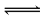 Al(OH)3+3H+
Al(OH)3+3H+
(3)若试剂1和试剂2均是稀硫酸,
①D为硫酸铁,检验铁离子的方法为取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+,
故答案为:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+;
②写出D→E反应的离子方程式2Fe3++Fe=3Fe2+;
③E为硫酸亚铁,与稀硫酸和亚硝酸钠为原料生成Fe(OH)SO4,反应中有NO生成,该反应为2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
本题难度:一般
3、填空题 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
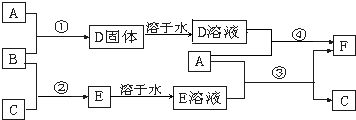
请回答:
(1)写出B物质的化学式:______;F的名称:______.
(2)写出第③步反应的化学方程式为______.
(3)第④步反应中溶液颜色的变化______;写出第④步反应的离子方程式______.
(4)写出SO2和B反应的离子方程式______.
(5)F溶液中滴入NaOH溶液可能产生的实验现象是______.
参考答案:A是用途最广的金属,则A为Fe;D溶液中滴加KSCN溶液显红色,则D中含有铁离子,B是常见气体单质,且具有强氧化性,所以B应为Cl2,依次推出D为FeCl3,F为FeCl2;结合转化关系图可知,Fe和E溶液反应生成FeCl2和C,则E为HCl,C为H2,
(1)由上述推断可知,B为Cl2,F为氯化亚铁,故答案为:Cl2;氯化亚铁;
(2)第③步反应为Fe与盐酸反应生成氯化亚铁和氢气,化学方程式为Fe+2HCl=FeCl2+H2↑,
故答案为:Fe+2HCl=FeCl2+H2↑;
(3)第④步反应为Fe与氯化铁反应生成氯化亚铁,离子反应为2Fe3++Fe=3Fe2+,观察到现象为溶液由黄色变为浅绿色,故答案为:溶液由黄色变为浅绿色;2Fe3++Fe=3Fe2+;
(4)B为Cl2,与SO2反应生成硫酸和盐酸,离子反应为SO2+Cl2+2H2O=4H++SO42-+Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+Cl-;
(5)F为FeCl2,其溶液中滴入NaOH溶液反应生成氢氧化亚铁白色沉淀,最终被氧化物红褐色的氢氧化铁沉淀,观察到现象为先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色,
故答案为:先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色.
本题解析:
本题难度:一般
4、实验题 (12分)请回答有关下列五种气体:H2、O2、NO、NH3、NO2的问 题。
I.(1)与制取O2的发生装置相同的是;______________只能用一种方法收集的是______________________________
(2)以上气体制备反应中,有一反应在原理上与其它反应都不能归为同一类型,请写出实验室制取该气体的方程式_________________________________
II. 用右图装置进行喷泉实验(图中夹持装置均已略去)。
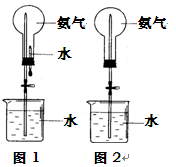
(1)若用图1装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是_____________________该实验的原理是______________________________________?
(2)若用图2的装置,请举一例说明引发喷泉的方法___________________________
III:若用同一烧瓶分别充满如下气体:①? HCl?②? NH3③? NO2进行喷泉实验,实验后烧瓶内溶液液面的高度关系为____________________________ (用序号和“>,<或=”表示,下同),所得溶液物质的量浓度大小关系为 ____________________________ 。
参考答案:I.(1)NH3;? NO、NH3、NO2(4分)
(2)2NH4Cl+Ca(OH)2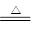 CaCl2+2NH3↑+2H2O?(2分)
CaCl2+2NH3↑+2H2O?(2分)
II.(1)打开止水夹,挤出胶头滴管中的水。(1分)
氨气极易溶解于水,致使烧瓶内气体压强迅速减小。(1分)
(2)打开夹子,用手(或热毛巾等)将烧瓶捂热?(1分)
III.①=②>③ (1分)?①=②=③?(2分)
本题解析:I、(1)选用气体的发生装置主要决定与物质的状态及反应条件,氧气是由固态MnO2催化的KClO3的分解,条件加热:2KClO3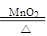 2KCl+3O2↑,故与实验室制取氨气的发生装置相同:Ca(OH)2+2NH4Cl
2KCl+3O2↑,故与实验室制取氨气的发生装置相同:Ca(OH)2+2NH4Cl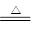 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
NO与氧气不能共存,只能用排水法收集;而NH3、NO2可溶于水或与水反应,不能用排水法收集,故只能用的排气法收集
(2)除氨气的制取外均为氧化还原反应:Ca(OH)2+2NH4Cl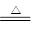 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
II.(1)打开止水夹,挤出胶头滴管中的水,由于氨气极易溶解于水,致使烧瓶内气体压强迅速减小,烧杯中的水就可在烧瓶中形成喷泉
(2)采用的方法只要能形成压强差即可形成喷泉,例如打开夹子,用手(或热毛巾等)将烧瓶捂热
III:由于HCl、NH3均极易溶于水,故整个烧瓶将被溶液占满,而3NO2+H2O=2HNO3+NO,故溶液只能占烧瓶容积的2/3
在同温同压下,三气体的体积相同,物质的量相同,所形成溶液的体积比为3:3:2,所形成溶液中溶质的物质的量比也为3:3:2,故所得溶液物质的量浓度均相同
本题难度:一般
5、填空题 (4分)在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
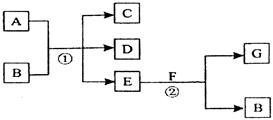
回答下列问题:
(1)A、G的化学式分别为____________、__________。
(2)写出反应②的化学方程式_______________________?_____。
参考答案:(1) Cl2 ;? O2?(各1分,)? (2) 2 Na2 O2 + 2 H2O ="4" NaOH + O2↑(2分)
本题解析:E常温下为无色无味的液体,所以E是水。F为淡黄色粉末,则F是过氧化钠。过氧化钠溶于水生成氢氧化钠和氧气,所以G是氧气,B是氢氧化钠。由于反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,所以A是氯气,C、D是氯化钠和次氯酸钠。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般