微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在三氯化铁和氯化铜的混合液中加入过量铁粉,完全反应后,剩余的固体的质量与所加铁粉的质量相等。混合溶液中三氯化铁与氯化铜的物质的量之比为
A.1:3
B.2:7
C.2:3
D.2:1
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴铜原子的基态电子排布式是? ▲?。比较第一电离能Cu? ▲?Zn(填 “>”、“=”、“<”),说明理由? ▲?。
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为? ▲?。(每个球均表示1个原子)
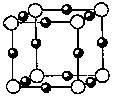
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为? ▲ 杂化,与NH3互为等电子体的粒子有? ▲?。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲? 。
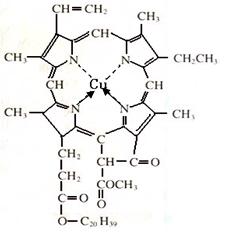
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。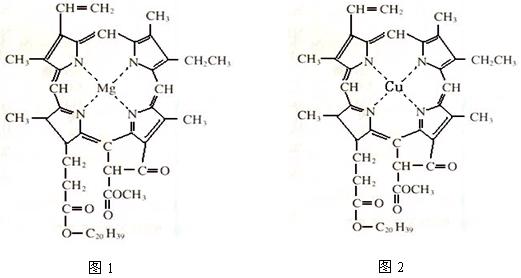
参考答案:(14分)
(1)① 1s22s22p63s23p63d104s1或[Ar] 3d104s1(2分)? <(1分) Cu失去1个电子后内层电子达到全充满的稳定状态(1分)
(2) Cu3N(2分)
(3)① SP3 ?H3O+ (各1分)
②Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3=Cu(NH3)42++2OH-(2分)
(3)(2分)
本题解析:略
本题难度:简单
3、填空题 钢铁工业是国家工业的基础,请回答:钢铁冶炼、腐蚀与防护过程中的有关问题。
(1)工业用热还原法冶炼生铁的主要原料有?,设备的名称是??写出用还原剂CO还原赤铁矿(主要成分为Fe2O3)的化学方程式
?。
(2)写出钢铁在潮湿空气中发生锈蚀时的正极反应方程式??
生成铁锈(Fe2O3..XH2O)的化学方程式为?.
(3)生铁的用途远远不及钢材广泛,人们把较多的高炉生铁直接冶炼成钢,由生铁直接在纯氧顶吹转炉中转化成钢时,是把有害杂质除掉而保留有益元素,可以概括为??
??。为了防止钢铁制品发生锈蚀,可以在钢铁零件的表面进行电镀铜等措施,电镀铜时的阳极反应为??。
参考答案:(1)铁矿石、焦炭、石灰石?高炉?
Fe2O3+3CO="2" Fe+3CO2?
(2)O2+2H2O+4e-=4OH-? 4 Fe+3O2+2XH2O="2" Fe2O3.XH2O?
(3)降碳、除硫、磷,脱氧,调硅锰? Cu-2e-=Cu2+
本题解析:略
本题难度:一般
4、简答题 试样A是由氧化铁和氧化铜组成.取质量相等的两份试样按下图进行实验,最后得到不溶物F和溶液G,不溶物F加入盐酸能放出气体.

(1)写出反应①中氧化铁与铝粉反应的反应方程式:______.
(2)溶液G中的溶质是______.
(3)写出反应②有关的两个离子方程式:______;______.
参考答案:依据流程图分析可知,试样A为氧化铜和氧化铁,加入过量铝粉高温反应,生成铁和氧化铝,固体B为Al、Al2O3、CuO、Fe;固体B加入过量氢氧化钠溶液为Al、Al2O3和氢氧化钠溶液反应生成偏铝酸钠溶液,过滤得到溶液D为偏铝酸钠溶液,固体E为CuO、Fe,溶液C为FeCl3,CuCl2溶液,最后得到不溶物F和溶液G,不溶物F加入盐酸能放出气体证明含有铁,说明铁过量,溶液G中溶质为FeCl2,
(1)反应①中氧化铁与铝粉反应的反应方程式为:Fe2O3+2Al高温.Al2O3+2Fe,
故答案为:Fe2O3+2Al高温.Al2O3+2Fe;
(2)结合分析过程可知G为氯化亚铁,故答案为:FeCl2;
(3)反应②有关的两个离子方程式是铝和氢氧化钠溶液反应,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑;氧化铝和氢氧化钠溶液反应,反应的离子方程式为:
Al2O3+2OH-=2AlO2-+H2O,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;Al2O3+2OH-=2AlO2-+H2O.
本题解析:
本题难度:一般
5、简答题 (14分)碱式硫酸铁[Fe(OH)SO4]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:

部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作__________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)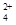 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。
Fe(OH)3的Ksp=____________。(提示,开始沉淀c(Fe3+)浓度为1.0×10-5mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO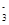 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
参考答案:(1)①4.4~7.5 ②H++HCO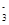 ===CO2↑+H2O,Al3++3HCO===Al(OH)3↓+3CO2↑
===CO2↑+H2O,Al3++3HCO===Al(OH)3↓+3CO2↑
(2)氧化剂 2 mol
(3)2Fe(OH)2++2H2O Fe2(OH)
Fe2(OH)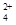 +2H+;10-37.4
+2H+;10-37.4
(4)酸性KMnO4溶液或铁氰化钾。
本题解析:(1)根据工艺流程可知加NaHCO3除去Al3+保留Fe2+,因而要控制pH使Al3+完全沉淀,而Fe2+不沉淀。(2)反应Ⅱ中通入的O2与NaNO2均作氧化剂,根据得失电子守恒,可以计算出标准状况下11.2 L O2与2 mol NaNO2得到的电子数相等。(3)依据原子守恒及电荷守恒可以写出Fe(OH)2+水解生成Fe2(OH)的离子方程式:2Fe(OH)2++2H2O Fe2(OH)
Fe2(OH)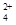 +2H+。pH=3.2时完全沉淀,c(H+)=10-3.2mol/L,c(OH-)=10-10.8mol/L,Ksp=c(Fe3+)·c3(OH-)=10-5×(10-10.8)3=10-37.4。(4)因产品中含Fe3+,可以用酸性KMnO4溶液检验Fe2+的存在,如含有Fe2+,则滴入几滴酸性KMnO4溶液后,溶液的紫色会褪去,否则不褪色。也可用铁氰化钾,溶液出现蓝色沉淀含有Fe2+,否则不产生蓝色沉淀
+2H+。pH=3.2时完全沉淀,c(H+)=10-3.2mol/L,c(OH-)=10-10.8mol/L,Ksp=c(Fe3+)·c3(OH-)=10-5×(10-10.8)3=10-37.4。(4)因产品中含Fe3+,可以用酸性KMnO4溶液检验Fe2+的存在,如含有Fe2+,则滴入几滴酸性KMnO4溶液后,溶液的紫色会褪去,否则不褪色。也可用铁氰化钾,溶液出现蓝色沉淀含有Fe2+,否则不产生蓝色沉淀
本题难度:简单