|
高考化学必考知识点《铁的氧化物》高频考点巩固(2017年模拟版)(四)
2017-07-18 00:34:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 &nb sp;用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。
(1)下列不易区别其真伪的方法是 ( )
A.测定密度
B.放入硝酸中
C.放入盐酸中
D.观察外观
| (2)你能判断出:合金的性质与组成合金的某单一金属的性质相同吗?
(3)你能举出生活中常见的合金的例子吗?
参考答案:(1)D? (2)不一样? (3)生铁、熟铁等
本题解析:铜锌合金的外观与金的外观极为相似,所以常有用铜锌合金来冒充金元宝进行诈骗的事例见诸于报端,所以观察外观不易区分假元宝的真伪。但铜锌合金的密度及与硝酸和盐酸反应的性质与金则存在着较大的差异,很容易将其伪装揭开。合金与其组分的性质不一样。生活中这样的合金的例子很多,如铁制品一般都是铁碳合金(只要合理即可)。
本题难度:一般
2、选择题 把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子
A.是Fe3+和Cu2+
B.是Fe2+和Cu2+
C.是Fe2+和Fe3+
D.只有Fe2+
参考答案:D
本题解析:表面的氧化物的量较少,溶于盐酸后,生成的Cu2+和Fe3+也较少,分别被单质铁还原为Cu和Fe2+,铜与盐酸不反应,铁与盐酸反应生成Fe2+。
本题难度:简单
3、填空题 利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下:
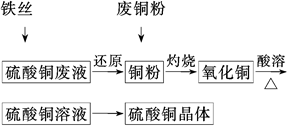
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有______________________________________________
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是___________________
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
参考答案:(1)Fe2O3+6H+=2Fe3++3H2O,
2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑
(2)C或CO 2CuO+C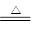 2Cu+CO2↑或CuO+CO 2Cu+CO2↑或CuO+CO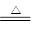 Cu+CO2 Cu+CO2
(3)2Cu+O2+2H2SO4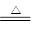 2CuSO4+2H2O 2CuSO4+2H2O
(4)生成等量CuSO4晶体所消耗的H2SO4更多,且会产生污染大气的气体
本题解析:废铁丝中含有铁锈(Fe2O3·xH2O),所以在用稀硫酸处理时可能发生的反应有:Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑;废铜粉在灼烧后得到的产物中含有单质铜,可能是原来杂质中含有C等还原性杂质导致;Cu在不断通入氧气和加热的条件下,可溶解于稀硫酸中,发生反应2Cu+O2+2H2SO4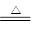 ?2CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓) ?2CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓)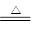 CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。 CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。
本题难度:一般
4、填空题 盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)
①在100mL 18molL-1的 浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是?。 浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是?。
A.40.32L? B.30.24L? C.20.16L? D.6.72L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式?。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 ?,反应中所消耗的硝酸的物质的量可能为?。
A.0.1mol? B.0.15mol? C.0.2mol? D.0.25mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为?。
参考答案:(1)
① D (2分),
②3Cu+3H++2NO3-=3Cu2++2NO+4H2O(2分)
(2)NO和NO2(2分),A (2分)
(3)Cu+2HCl+2H2O2=CuCl2+2H2O(2分)。
本题解析:略
本题难度:简单
5、选择题 足量的一氧化碳还原14.5 g铁的氧化物的混合物。将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则该混合物的组合不可能是
①Fe2O3、Fe3O4、FeO;②FeO、Fe3O4;③Fe3O4、Fe2O3;④FeO、Fe2O3
A.①②
B.②③
C.③④
D.①④
参考答案:B
本题解析:CO还原铁的氧化物生成CO2,CO2与氢氧化钙反应生成碳酸钙,即25g是碳酸钙的质量,物质的量=25g÷100g/mol÷0.25mol。则根据原子守恒可知CO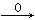 CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的质量=14.5g-4g=10.5g,物质的量=105.g÷56g/mol=0.1875mol,所以金属氧化物中铁与氧元素的个数之比=0.1875:0.25=3:4。由于氧化铁与氧化亚铁按照物质的量之比1:1混合即可以满足铁与氧元素的个数之比=3:4,所以选项①、④均有可能,而选项②③不可能满足铁与氧元素的个数之比=3:4,因此正确的答案选B。 CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的质量=14.5g-4g=10.5g,物质的量=105.g÷56g/mol=0.1875mol,所以金属氧化物中铁与氧元素的个数之比=0.1875:0.25=3:4。由于氧化铁与氧化亚铁按照物质的量之比1:1混合即可以满足铁与氧元素的个数之比=3:4,所以选项①、④均有可能,而选项②③不可能满足铁与氧元素的个数之比=3:4,因此正确的答案选B。
本题难度:简单
|