微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)
Ⅰ.在一定条件下的下列可逆反应达到平衡时,试填出:x A+y B z 91EXAM.org C
z 91EXAM.org C
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是________;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向_____方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是______(填状态);
(4)如加热后,C的百分含量减小,则正反应是________热反应。
Ⅱ.如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2? mol Y,起始时,V(A)=V(B)=" a" L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g) 2Z(g)+W(g);ΔH<0。达到平衡时,V(A)=" 1.2a" L。
2Z(g)+W(g);ΔH<0。达到平衡时,V(A)=" 1.2a" L。
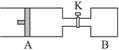
试回答:
(1)A中X的转化率α(A)___________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
参考答案:Ⅰ.(1)x+y>z(2)逆反应方向(或向左移动)(3)固或液((4)放热
Ⅱ(1)40%? (2)>? (3)2.6a
本题解析:I、(1)减压平衡向气体体积增大的方向移动,所以逆反应为气体体积增大的反应,则x、y、z关系是x+y>z;
(2)增压平衡向气体体积减小的方向的移动,由C是气体,并且x+y=z,则平衡必向逆反应方向移动;
(3)B、C是气体,现增加A物质的量,平衡不移动,说明A是固体或液体;
(4)加热平衡向吸热反应方向移动,由于加热后C的含量减小,则正反应为放热反应;
II、(1)40%? (2)>? (3)2.6a
本题难度:一般
2、选择题 在一定条件下,

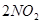 达到平衡的标志是
达到平衡的标志是
A.NO、O2、NO2分子数目比是2:1:2
B.反应混合物中各组分物质的浓度相等
C.混合气体的颜色不再变化
D.混合气体的平均相对分子质量改变
参考答案:C
本题解析:判断某可逆反应达到平衡的本质是:(1)正反应速率等于逆反应速率;(2)反应体系中各组分的浓度保持不变;
A错,反应体系中各组分粒子数之比等于化学计量数之比不一定达到平衡;
B错,反应混合物中各组分物质的浓度相等也不能说明达到平衡;
C正确,混合气体的颜色不再变化,说明各组分的浓度不变,即达到了平衡状态;
D错,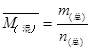 平衡相对分子质量改变,说明反应未达平衡,还会发生移动。
平衡相对分子质量改变,说明反应未达平衡,还会发生移动。
本题难度:一般
3、选择题 在一个固定体积的密闭容器中,放入3L X(气)和2L Y(气),在一定条件下发生下列反应 4 X (g) + 3 Y(g) 2 Q(g) + n R(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小33.3%,则该反应方程式的n值是(? )
2 Q(g) + n R(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小33.3%,则该反应方程式的n值是(? )
A? 6? B? 5? C? 4? D? 3
参考答案:A
本题解析:达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,所以4+3<2+n,解得n>5,所以选项A正确,答案选A。
本题难度:一般
4、选择题 下列有关反应限度的说法错误的是
A.某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关
B.炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.可逆反应的限度不随反应条件的改变而改变
参考答案:D
本题解析:A.某条件下可逆反应达到限度之前,反应从正反应方向开始,逆反应速率逐渐增大,就是由于反应物不断反应变为生成物,使生成物浓度逐渐增大。物质的浓度越大,反应速率也就越快。正确。B.在炼铁高炉中发生的CO还原氧化铁的反应是可逆反应。当反应达到该条件下的反应限度时,无论高炉高度改变与否,尾气中CO含量不随而改变。正确。C.当化学反应达到该条件下的化学反应的限度时,各种反应物也就得到了在该条件下的最大转化率,因此化学反应的限度决定了反应物在该条件下的最大转化率。正确。D.可逆反应的限度是在一定条件下的限度。若外界条件发生改变,则平衡被破坏,就会达到新的条件下的新的限度,因此会随反应条件的改变而改变。错误。
本题难度:一般
5、选择题 在一定条件下,在体积固定的密闭容器中进行的可逆反应N2 +3H2 2NH3,下列说法能表明该反应达到平衡状态的是(?)
2NH3,下列说法能表明该反应达到平衡状态的是(?)
A.生成氨的速率与分解氨的速率相等
B.断开一个N≡N,同时有六个N-H键生成
C.N2、H2,、NH3的浓度相等
D.混合气体总压不再改变
参考答案:AD
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以A正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此C不正确。B中反应速率的方向是相同的,不能说明。反应前后体积是变化的,即压强也是变化的,所以当压强不在发生变化时可以说明,所以答案选AD。
本题难度:简单