|
高考化学知识点整理《未知》答题技巧(2017年最新版)(六)
2017-07-18 00:39:01
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 17.⑴(9分)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10 ,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
①请写出方框内物质的化学式: 。
②针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
③若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾
B.硫酸锰
C.水
D.氯化锰
|
参考答案:CO2;催化剂;B
本题解析:根据原子守恒,反应物含O原子40个,C原子10个,反应后产物即为10CO2;KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想可能是催化剂的作用;要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可。
考点:氧化还原反应方程式的配平、化学反应速率的影响因素
点评:本题考察了氧化还原反应的配平及影响反应速率的因素,难度较小,要把握质量守恒定律的应用。
本题难度:一般
2、选择题 氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
[? ]
A.这“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
参考答案:D
本题解析:
本题难度:简单
3、填空题 (16分)碳氧化物的转化有重大用途,回答关于CO和CO2的问题。
(1)己知:① C (s) + H2O(g)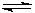 CO (g) +H2 (g) △H1 CO (g) +H2 (g) △H1
② 2CO(g) + O2(g) = 2CO2 (g) △H2
③H2O (g)= H2 (g) +1/2 O2 (g) △H3
则C (s) + O2 (g) =CO2 (g)的△H = (用△H1、△H2、△H3表示)。
(2)对于化学平衡①,在不同温度下,CO的浓度与反应时间的关系如图所示,
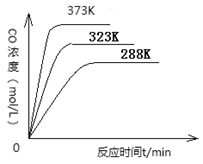
由图可得出如下规律:随着温度升高,① ;② 。
(3)某温度下,将6.0 mol H2O(g)和足量碳充入3 L的恒容密闭容器中,发生如下反应: C (s) + H2O(g)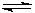 CO (g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程) CO (g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
(4)在神州九号飞船中,宇航员呼出的CO2也可以采用Na2O2吸收,写出相关的化学方程式并标明电子转移的方向和数目: 。
参考答案:(16分)(1)(ΔH1+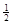 ΔH2-ΔH3)(3分) ΔH2-ΔH3)(3分)
(2)①在同一时间CO的生成浓度大;②反应的速率加快,达到平衡的时间缩短。(各2分)(3)20%(6分)
(4)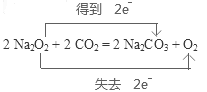 (或者单线桥表示法)(3分) (或者单线桥表示法)(3分)
本题解析:(1)①+②÷2-③,整理可得:C (s) + O2 (g) =CO2 (g)的△H =(ΔH1+ ΔH2-ΔH3);(2)对于化学平衡①,根据图示可知如下规律:随着温度升高,在同一时间CO的生成浓度大;②反应的速率加快,达到平衡的时间缩短。(3)某温度下,将6.0 mol H2O(g)和足量碳充入3 L的恒容密闭容器中,发生如下反应: C (s) + H2O(g) ΔH2-ΔH3);(2)对于化学平衡①,根据图示可知如下规律:随着温度升高,在同一时间CO的生成浓度大;②反应的速率加快,达到平衡的时间缩短。(3)某温度下,将6.0 mol H2O(g)和足量碳充入3 L的恒容密闭容器中,发生如下反应: C (s) + H2O(g) CO (g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),则K=0.1。假设水反应的物质的量浓度为x,则达到平衡时各种物质的浓度是:c(CO)=c(H2)=xmol/L,c(H2O)=(2-x)mol/L由于K= c(CO)·c(H2)/ c(H2O),所以x2/(2.0-x)=0.1解得x=0.4,H2O(g)转化率为0.4/2 x100% =20%(1分)答:H2O(g)转化率为20%;(4)在神州九号飞船中,宇航员呼出的CO2也可以采用Na2O2吸收,则相关的化学方程式并标明电子转移的方向和数目: CO (g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),则K=0.1。假设水反应的物质的量浓度为x,则达到平衡时各种物质的浓度是:c(CO)=c(H2)=xmol/L,c(H2O)=(2-x)mol/L由于K= c(CO)·c(H2)/ c(H2O),所以x2/(2.0-x)=0.1解得x=0.4,H2O(g)转化率为0.4/2 x100% =20%(1分)答:H2O(g)转化率为20%;(4)在神州九号飞船中,宇航员呼出的CO2也可以采用Na2O2吸收,则相关的化学方程式并标明电子转移的方向和数目: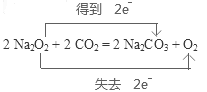
考点:考查盖斯定律的应用、温度对化学反应速率和化学平衡移动的影响、物质平衡转化率的计算、氧化还原反应电子转移的表示的知识。
本题难度:一般
4、选择题 为了测定某铜银合金成分,将30 g合金完全溶于80 mL 13.5 mol/L的浓硝酸中,待反应完全后,收集到0.3 mol气体,并测得溶液中c(H+)是1 mol/L。假设反应后溶液体积仍为80 mL,则合金中银的质量分数为
A.36%
B.66.3%
C.78.7%
D.96.6%
参考答案:A
本题解析:
试题分析由于HNO3的还原产物为NO或NO2或二者的混合物,根据N原子守恒:则被还原的HNO3的物质的量等于气体的物质的量:n(HNO3)="=0.3" mol,设合金中银的质量为x,则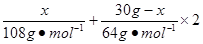 =13.5mol·L-1×0.08L-1mol·L-1×0.08L-0.3mol,x="10.8" g =13.5mol·L-1×0.08L-1mol·L-1×0.08L-0.3mol,x="10.8" g
银的质量分数:w(Ag)=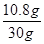 ×100%=36%。 ×100%=36%。
本题难度:一般
5、填空题 (8分)在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,
(1)m=________(填数字)
(2)R3+是___________(填氧化产物、还原产物)
(3)用双线桥法表示电子转移的方向和数目___________
(4)若氧化等量的R2+,消耗的高锰酸钾与氧气的物质的量之比为___________,
参考答案:

本题解析:略
本题难度:简单
|