微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4,下列说法正确的是(?)
A.只有硫酸铜作氧化剂
B.SO42-既不是氧化产物又不是还原产物
C.被氧化的硫与被还原的硫的质量比为3:7
D.1mol硫酸铜可以氧化5/7mol的硫原子
参考答案:C
本题解析:A.FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,所以FeS2中S元素部分被氧化,部分被还原,FeS2既是氧化剂又是还原剂,故A错误;B.SO42-是氧化产物,故B错误;C.由化学方程式可知,反应物中含有14molSO42-离子,生成物中有17molSO42-离子,则有3molS被氧化,7molS被还原,故C正确;D.14mol硫酸铜对应的被氧化的硫原子是3mol,故1mol硫酸铜可以氧化3/14mol的硫原子,故D错误.故选:C。
本题难度:一般
2、填空题 (10分)按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式: 。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为: 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为
。
参考答案:(每空2分)(1)PbO2+4HCl(浓) PbCl2+ Cl2↑+2 H2O
PbCl2+ Cl2↑+2 H2O
(2)2ClO2-+ Cl2= ClO2+2Cl-
(3)3MnO2+KClO3+6KOH 3K2MnO4+KCl+3 H2O 2:1
3K2MnO4+KCl+3 H2O 2:1
(4)2NaOH+(CN)2="NaCN+NaOCN+" H2O
本题解析:(1)黄绿色气体是氯气,说明氧化铅与浓盐酸反应生成氯气,化学方程式为PbO2+4HCl(浓) PbCl2+ Cl2↑+2 H2O
PbCl2+ Cl2↑+2 H2O
(2)Cl2氧化NaClO2溶液制取ClO2,则氯气被还原为氯离子,离子方程式为2ClO2-+ Cl2= ClO2+2Cl-
(3)根据氧化还原反应理论,MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,同时氯酸钾被还原为氯化钾,反应的化学方程式3MnO2+KClO3+6KOH 3K2MnO4+KCl+3 H2O;K2MnO4中的Mn的化合价是+6价,KMnO4中Mn的化合价是+7价,而MnO2中Mn的化合价是+4价,根据得失电子守恒规律,KMnO4和MnO2的物质的量之比为2:1;
3K2MnO4+KCl+3 H2O;K2MnO4中的Mn的化合价是+6价,KMnO4中Mn的化合价是+7价,而MnO2中Mn的化合价是+4价,根据得失电子守恒规律,KMnO4和MnO2的物质的量之比为2:1;
(4)仿照氯气与氢氧化钠溶液反应的化学方程式,(CN)2与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2="NaCN+NaOCN+" H2O
考点:考查化学方程式的判断与书写
本题难度:一般
3、选择题 二战期间,丹麦科学家玻尔被迫离开德军占领的祖国。为了表明一定要返回祖国的决心,他把自己获得的金质诺贝尔奖章放在盛有王水的玻璃瓶中留了下来:Au+HNO3+3HCl====AuCl3+NO↑+2H2O。战后玻尔从溶液中提取金,又重新铸成了奖章。下列方法中,你认为不能从溶有黄金的王水中提取金的是(? )
A.用铁置换
B.电解其水溶液
C.先蒸发水分后灼烧固体
D.过滤
参考答案:D
本题解析:Au属于不活泼金属,用电解法、置换法、热分解法,均可以得到Au,但不能用过滤法,因为AuCl3是水溶液,不是沉淀。
本题难度:简单
4、选择题 在KClO3+6HCl(浓)=KCl+3Cl2+3H2O的反应中,当有10 mol电子发生转移后,被氧化的氯原子与被还原的氯原子的物质的量之比是
A.1∶5
B.5∶1
C.6∶1
D.1∶6
参考答案:B
本题解析:在KClO3+6HCl(浓)=KCl+3Cl2+3H2O的反应中,KClO3中氯元素降低到0价,6HCl中有5 mol被氧化,升高到0价,转移电子5 mol,被氧化的氯原子与被还原的氯原子的物质的量之比是5:1。
本题难度:一般
5、选择题
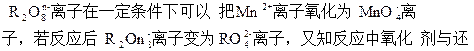
原剂的物质的量之比为5∶2。则n的值是?
A.1
B.2
C.3
D.4
参考答案:B
本题解析: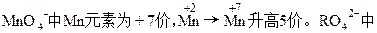
R元素为+6价。设R2O8n-中R元素的化合价为+x价关系式:5R2O8n-~2Mn2+
5×2×(x-6)=5×2
x=7
R2O8n-中,2×7+(-2)×8=-n
n=2
本题难度:一般