| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》考点强化练习(2017年押题版)(六)
参考答案:C 本题解析:pH之和等于14的酸碱等体积混合,因为氨水是弱碱,继续电离,所以显碱性。 本题难度:困难 3、填空题 (10分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。 参考答案:(1)B(2)5 反应后烧杯中自由离子的浓度约为原溶液的一半 6.5 本题解析:(1)根据图示中滴定管构造可知,该滴定管为酸式滴定管,则滴定管中盛放的为酸,即A溶液,则烧杯中盛放为碱溶液B,故答案为:B;(2)该温度下,水的离子积Kw=l×10-13,a+b=13的一元强酸和一元强碱等体积混合,溶液呈中性,反应后的溶液为盐溶液,由于体积变成原先的2倍,离子浓度则变为原先的1/2,所以溶液的导电性为5;根据水的离子积可知,该温度下,中性溶液中氢离子浓度为:l×10-6.5mol/L,溶液的pH=6.5,故答案为:5;反应后烧杯中自由离子的浓度约为原溶液的一半;烧杯中得到的溶液pH 为6.5;(3)当溶液呈中性时,有电荷守恒可知,溶液中阳离子所带电荷总浓度应该等于阴离子所带负电荷总浓度,而现在阳离子浓度大于阴离子浓度,可知1个阴离子所带电荷大于1个阳离子所带电荷,即A为多元强酸,故答案为:A为多元强酸;(4)若A的化学式为HA,B的化学式为BOH,且a+b=13,当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,测得烧杯中溶液pH大于“(2)”中最后得到的溶液pH,说明反应后的溶液显示碱性,则B为弱碱,且反应前溶液中A中c(H+)=B中c(OH-),即反应前c(B)>>c(A),两溶液等体积反应后,B过量;由于B过量,则溶液中c(B+)>c (A-),溶液显示碱性,则c(OH-)>c(H+),反应反应后的溶液中离子浓度大小关系为:c(B+)>c (A-)>c(OH-)>c(H+),A为多元强酸B为弱碱,故该水解反应的离子方程式为; M++H2O 本题难度:困难 4、选择题 常温时,向pH=12的Ba(OH)2溶液中加入等体积的下列溶液后,滴入酚酞试液出现红色,该溶液应该是 |
参考答案:D
本题解析:
常温下,酚酞试液的变色范围:8-10,滴入酚酞试液出现红色,说明混合液显碱性。
A、向pH=12的Ba(OH)2溶液中加入等体积的pH=2的硫酸溶液,二者的氢离子和氢氧根恰好完全反应,呈中性,故A不合题意;
B、向pH=12的Ba(OH)2溶液中加入等体积的pH=2的醋酸溶液,醋酸过量,混合液显酸性,故B不合题意;
C、向pH=12的Ba(OH)2溶液中加入等体积的0.05mol/L盐酸溶液,盐酸过量,混合液显酸性,故C不合题意;
D、向pH=12的Ba(OH)2溶液中加入等体积的0.05mol/LNa2SO4溶液,反应生成硫酸钡沉淀和氢氧化钠,混合液显碱性,故D符合题意。
考点:考查酸碱中和反应、指示剂的变色范围
点评:本题考查了酸碱中和反应、指示剂的变色范围,难度不大。易错点是涉及到弱酸的PH与酸的浓度的关系,如B项,误以为是酸碱恰好完全反应。
本题难度:一般
5、选择题 下列能正确表示水解的离子方程式是
[? ]
A.CH3COOH + H2O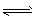 CH3COO- + H3O+
CH3COO- + H3O+
B.Br- + H2O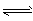 HBr + OH-
HBr + OH-
C.CO32- + 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
D.NH4+ + H2O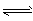 NH3·H2O + H+
NH3·H2O + H+
参考答案:D
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《未知》答题.. | |