微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)某海域海水一些化学成分如下表
海水成分
| Na+
| Ca2+
| Mg2+
| HCO3-
| Zn2+
|
含量/mol·L-1
| 0.4
| 0.002
| 0.045
| 0.002
| 10-7
|
已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=1.8×10-11。
某化学小组同学欲在实验制备MgCl2,并提取Zn。设计流程如下:
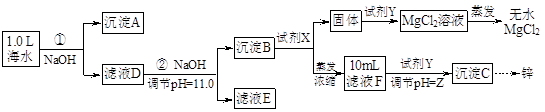
[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH为8.0,其原因是(写离子方程式) 。
(2)下图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图。
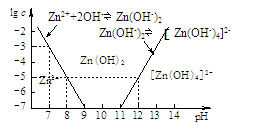
请结合图中数据回答:
试剂X的化学式为 ;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH的范围为 。
(3)同学们发现,把MgCl2溶液蒸发、灼烧所得的白色固体难溶解于水,于是认为其主要成分是MgO。你认为 (填“正确”、“不正确”),原因是(用化学方程式表示) 、 。
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp= 。
2、选择题 在0.1mol/L的Na2CO3的溶液中,下列关系式正确的是
A.c(Na+)>c(CO32-)> c(OH-)> c(H+)
B.c(OH-)= c(HCO3-)+ c(H2CO3)
C.2c(Na+)=c(CO32-)+ c(HCO3-)> c(H2CO3)
D.c(Na+)+ c(H+)= c(OH-) + c(HCO3-) +2c(CO32-)