微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关物质性质和该性质的应用均正确的是
A.二氧化锰具有强氧化性,可用作H2O2分解的氧化剂
B.K2FeO4具有还原性,可用于自来水的杀菌消毒
C.Fe3+具有氧化性,可溶解印刷线路板上的金属铜
D.二氧化硫和氯水均具有漂白性,可将两者混合使用增强漂白效果
参考答案:C
本题解析:分析:A.反应中二氧化锰作催化剂;
B.K2FeO4中Fe为+6价,具有强氧化性;
C.Fe3+具有氧化性,与Cu发生氧化还原反应;
D.二氧化硫和氯水均具有漂白性,两者混合反应生成硫酸和盐酸.
解答:A.在双氧水的分解反应中二氧化锰作催化剂,故A错误;
B.K2FeO4中Fe为+6价,具有强氧化性,可用于自来水的杀菌消毒,故B错误;
C.Fe3+具有氧化性,与Cu发生氧化还原反应,所以可溶解印刷线路板上的金属铜,故C正确;
D.二氧化硫和氯水均具有漂白性,两者混合反应生成硫酸和盐酸,等物质的量混合时漂白失效,故D错误;
故选C.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意利用元素的价态分析其性质,题目难度不大.
本题难度:困难
2、选择题 将80gNaOH溶于水配成1L溶液,该溶液的物质的量浓度为
A.1mol/L
B.2mol/L
C.3 mol/L
D.4mol/L
参考答案:B
本题解析:NaOH物质的量为2mol,故该溶液的物质的量浓度为2mol/L,选B
本题难度:一般
3、选择题 120℃时,将氢气、水蒸气和二氧化碳的混合气体通过足量过氧化钠后,再将所得气体点燃,恰好能完全反应.则下列关系式可能存在的是
A.V(H2)∶V(H2O)∶V(CO2)=2∶1∶1
B.V(H2)∶V(H2O)∶V(CO2)=2∶2∶1
C.V(H2)∶V(H2O)∶V(CO2)=1∶1∶2
D.V(H2)∶V(H2O)∶V(CO2)=4∶1∶2
参考答案:A
本题解析:二氧化碳、水蒸气都可以与过氧化钠反应生成氧气.两个反应中反应前后的气体体积比都是2∶1,直接根据各选项中给出的量得出氧气的量,最后根据氢气与氧气是否完全反应,得出正确结论.
本题难度:简单
4、选择题 在体积为x L的密闭容器中通入a mol?NO和b mol?O2,反应后容器内氮原子数和氧原子数之比为
A.
B.
C.
D.
参考答案:C
本题解析:分析:根据原子守恒,反应前的原子数目等于反应后的原子数目来解答.
解答:反应前N原子总数是amol(全部在NO中),O原子总数是(a+2b)mol(NO中有O原子,O2中也有O原子),
根据原子守恒:反应后原子个数不变,所以氮原子和氧原子个数之比=a:(a+2b),
故选C.
点评:本题考查了质量守恒定律的应用,培养了学生解题时的分析和应变能力.
本题难度:一般
5、选择题 1.7克化合物H2A含有3.01×1022个H2A分子,则H2A的相对分子质量为
A.17
B.34
C.16
D.32
参考答案:B
本题解析:分析:先通过分子数计算物质的量,再根据质量、物质的量的关系计算摩尔质量,摩尔质量在数值上与其相对分子质量相等,从而得出相对分子质量.
解答:根据N=n×NA 得n═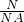 ═=
═=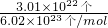 =0.05mol,
=0.05mol,
根据m=n×M得M=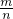 =
=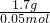 =34g/mol,
=34g/mol,
摩尔质量在数值上与其相对分子质量相等,所以其相对分子质量是34.
故选B
点评:本题考查的是有关物质的量的计算,不仅要记住基本公式还要会推导,分清物质的量、质量、分子数、摩尔质量之间的关系是解题的关键,做题时要细心,注意题中给出的是分子数还是原子数,才能正确解答.
本题难度:困难