|
高考化学知识点总结《键参数——键能、键长与键角》高频考点巩固(2017年模拟版)(四)
2017-07-18 00:41:12
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。?
(2)元素⑥形成的最高价含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp2杂化
| (4)某元素的特征电子排布式为nsnn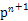 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是?。 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是?。
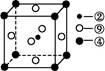
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。?
参考答案:(1)⑨ (2)正四面体形 sp3 (3)BD
(4)3 三角锥形 在NH3分子和水分子间有氢键作用
(5)MgNi3C
本题解析:(1)根据元素周期表结构可回答。(2)⑥对应的含氧酸根是S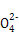 ,根据电子互斥理论,可判断S ,根据电子互斥理论,可判断S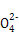 为正四面体结构,中心原子采用sp3杂化。(3)元素②为碳元素,根据该元素的氢化物地位和用途可判断该氢化物为CH2 为正四面体结构,中心原子采用sp3杂化。(3)元素②为碳元素,根据该元素的氢化物地位和用途可判断该氢化物为CH2 CH2(乙烯),该分子中C—H键为σ键,C CH2(乙烯),该分子中C—H键为σ键,C C双键中有一个σ键和一个π键,其中C原子采用sp2杂化。该分子高度对称,属于非极性分子。选项BD正确。(4)nsnn C双键中有一个σ键和一个π键,其中C原子采用sp2杂化。该分子高度对称,属于非极性分子。选项BD正确。(4)nsnn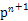 为p区元素,原子排布到p轨道时,s轨道应填充2个电子,故n=2,该元素的最外层电子排布为2s22p3。该元素为N元素,其中2s轨道中的电子为孤电子对。①为H元素,N与H形成NH3,由于N原子存在孤电子对,故NH3分子为三角锥形。①和③形成的化合物为H2O,NH3和H2O之间可形成氢键,故NH3易溶于水。(5)②、④、⑨对应的元素为C、Mg和Ni元素。C原子处于体心,即平均每个晶胞含有1个碳原子;Mg原子处于顶点,平均Mg原子个数为8×1/8=1;Ni原子位于面心,Ni原子个数为6×1/2=3,该化合物化学式为MgNi3C。 为p区元素,原子排布到p轨道时,s轨道应填充2个电子,故n=2,该元素的最外层电子排布为2s22p3。该元素为N元素,其中2s轨道中的电子为孤电子对。①为H元素,N与H形成NH3,由于N原子存在孤电子对,故NH3分子为三角锥形。①和③形成的化合物为H2O,NH3和H2O之间可形成氢键,故NH3易溶于水。(5)②、④、⑨对应的元素为C、Mg和Ni元素。C原子处于体心,即平均每个晶胞含有1个碳原子;Mg原子处于顶点,平均Mg原子个数为8×1/8=1;Ni原子位于面心,Ni原子个数为6×1/2=3,该化合物化学式为MgNi3C。
本题难度:一般
2、选择题 下列各组物质中,所有化学键都是共价键的是
[? ]
A.H2S和Na2O2
B.NH3和N2
C.H2O2和CaF2
D.HNO3和NaCl
参考答案:B
本题解析:
本题难度:简单
3、简答题 U、V、W、X、Y、Z是原子序数依次增大的六种短周期元素.U的单质在W2中燃烧可生成UW和UW2两种气体.X的单质是一种金属,其在W2中燃烧可生成淡黄色固体.Z的单质在W2中燃烧的产物可使品红溶液褪色.Y的单质也是一种金属,该单质在UW2中剧烈燃烧生成黑、白两种固体.
请回答下列问题:
(1)V的单质分子的结构式为______;Y?W的电子式为______;
(2)按顺序写出U、V、W与氢元素形成的10电子氢化物的化学式______、______、______;
V、W的氢化物分子结合H+能力较强的是(写化学式)______.
(3)将ZW2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体VW,有关反应的离子方程式为______.
参考答案:U、V、W、X、Y、Z是原子序数依次增大的六种短周期元素.Z的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Z为S元素,W为O元素;X的单质是一种金属,其在W2中燃烧可生成淡黄色固体,该淡黄色固体为Na2O2,则X为Na元素;的单质在W2中燃烧可生成UW和UW2两种气体,应为CO和CO2气体,U为C元素;V的原子序数介于碳元素与氧元素之间,则V为N元素;Y的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,
(1)V为N元素,其单质为N2,结构为N≡N;
YW为MgO,为离子化合物,电子式为
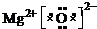
,
故答案为:N≡N;
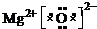
;
(2)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,NH3的水溶液呈碱性,与水比较更易结合H+,可用NH3+H3O+=NH4++H2O的反应来证明,
故答案为:CH4、NH3、H2O;NH3+H3O+=NH4++H2O;
(3)SO2具有较强还原性,可用强氧化性物质HNO3发生氧化还原反应,生成硫酸,加入氯化钡生成硫酸钡沉淀,反应的离子方程式为3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+.
本题解析:
本题难度:一般
4、选择题 下列物质性质的变化规律,与共价键的键能大小有关的是
[? ]
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.H2O、H2S、H2Se、H2Te的热稳定性依次减弱
C.Na、Mg、Al的还原性依次减弱
D.NaF、NaCl、NaBr、NaI的熔点依次降低
参考答案:B
本题解析:
本题难度:一般
5、填空题 如表是元素周期表的一部分,回答下列问题:

(1)写出①---(12)号元素的元素符号①______?②______?③______?④______
⑤______?⑥______?⑦______?⑧______?⑨______?⑩______?(11)______?(12)______
(2)写出①、③两种元素形成的化合物有两种,化学式:______,______.
(3)写出①元素最高价氧化物的电子式和结构式______,______.
(4)这些元素的最高价氧化物的对应水化物中______酸性最强;______碱性最强;能形成两性氢氧化物的元素是______,形成两性氢氧化物化学式______.
参考答案:(1)根据元素所在周期表中的位置不难判断①---(12)号元素依次为:C、N、O、F、Na、Mg、Al、Si、P、S、Cl、Ar,故答案为:C;N;O;F;Na;Mg;Al;Si;P;S;Cl;Ar;
(2)①为C元素,化合价有+2价和+4价,③为O元素,所以对应的化合物有CO和CO2,故答案为:CO;CO2;
(3)C元素最高价氧化物是CO2,为共价化合物,电子式为
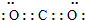
,空间结构为直线形分子,C和O原子之间存在C=O键,结构式为O=C=O,
故答案为:
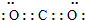
;O=C=O;
(4)周期表中,同周期元素从左到右元素的非金属性逐渐增强,金属性逐渐减弱,同主族元素从上到下元素的非金属性逐渐减弱,金属性逐渐增强,则非金属性最强的元素为F,但F无正价,对应最高价氧化物的对应水化物酸性最强的为
HClO4,金属性最强的元素为Na元素,最高价氧化物的对应水化物NaOH碱性最强,能形成两性氢氧化物的元素是Al元素,对应的氢氧化物为Al(OH)3,
故答案为:HClO4;NaOH;Al;Al(OH)3.
本题解析:
本题难度:简单
|
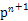 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是?。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是?。