微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能鉴别SO2和CO2的试剂是
A.湿润的蓝色石蕊试纸
B.澄清石灰水
C.品红试液
D.氯化钡溶液
参考答案:C
本题解析:
本题难度:简单
2、选择题 在4℃时向100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液.下列说法中不正确的是
A.该溶液物质的量浓度为10mol?L-1
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数约为26.7%
D.所得溶液的体积为22.5L
参考答案:AD
本题解析:分析:A、标准状况下22.4LHCl的物质的量为1mol,根据题目信息无法计算溶液的体积;
B、因溶液的密度未知,无法计算溶液的体积;
C、溶液质量=溶质质量+溶剂质量,溶质质量分数=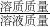 ×100%,据此计算;
×100%,据此计算;
D、溶液体积不等于溶剂与溶质的体积之和,利用V= 计算溶液体积.
计算溶液体积.
解答:A、标准状况下22.4LHCl的物质的量为1mol,溶于水配成100mL溶液,溶液的浓度为10mol/L,而水的体积为100mL,因溶液的密度未知,无法计算溶液的体积,无法计算该溶液的物质的量浓度,故A错误;
B、因溶液的密度未知,无法计算溶液的体积,无计算该溶液的物质的量浓度,故B正确;
C、标准状况下22.4LHCl的物质的量为1mol,质量为36.5g,4℃时100mL水的质量为100g,所以溶液溶质的质量分数为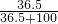 ×100%=26.74%,故C正确;
×100%=26.74%,故C正确;
D、溶液体积不等于溶剂与溶质的体积之和,因溶液的密度未知,无法计算溶液的体积,故D错误.
故选AD.
点评:本题考查对物质的量浓度理解、质量分数计算等,难度不大,注意物质的量浓度及与质量分数的关系.
本题难度:简单
3、选择题 与30mL?1mol/L的MgCl2溶液中Cl-浓度相同的是
A.150mL?0.2mol/L?FeCl2溶液
B.90mL?2mol/L?NaCl溶液
C.60mL?1mol/LAlCl3溶液
D.30mL?0.5mol/L?CaCl2溶液
参考答案:B
本题解析:分析:电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,1mol/L的MgCl2溶液中Cl-浓度为2mol/L,据此结合选项判断.
解答:1mol/L的MgCl2溶液中Cl-浓度为2mol/L,
A、150mL?0.2mol/L?FeCl2溶液中Cl-浓度为0.2mol/L×2=0.4mol/L,故A不符合;
B、90mL?2mol/L?NaCl溶液中Cl-浓度为2mol/L×1=2mol/L,故B符合;
C、60mL?1mol/LAlCl3溶液中Cl-浓度为1mol/L×3=3mol/L,故C不符合;
D、30mL?0.5mol/L?CaCl2溶液中Cl-浓度为0.5mol/L×2=1mol/L,故D不符合;
故选B.
点评:本题考查物质的量浓度,比较基础,注意电解质溶液中离子的浓度与电解质浓度的计算.
本题难度:简单
4、选择题 H2S、SO2、SO3共同具有的性质是
A.还原性
B.氧化性
C.水溶液显酸性
D.标准状态下都是气体
参考答案:C
本题解析:H2S、SO2在标准状况下都是气体,SO3在标准状况下是固体;三者的水溶液都显酸性.
本题难度:一般
5、选择题 下列物质均具有漂白作用,其中一种与另外三种的漂白原理不同的是
A.HClO
B.H2O2
C.SO2
D.O3
参考答案:C
本题解析:A、B、D三项物质均有强氧化性,能使有色物质褪色;C项SO2能与某些有色物质化合生成无色不稳定的物质.
本题难度:简单