|
高考化学知识点总结《键参数——键能、键长与键角》高频试题巩固(2017年最新版)(十)
2017-07-18 00:43:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是( )
A.T的氧化物是光导纤维的主要成分
B.W的氢化物的化学式为HCl
C.R的最高正价氧化物的水化物是弱电解质
D.Q与氢形成的化合物均含极性共价键
| 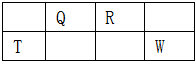
参考答案:短周期元素Q、R、T、W,根据元素所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素,
A、T的氧化物是三氧化二铝,光导纤维的主要成分是二氧化硅,故A错误;
B、W为硫元素,其气态氢化物为H2S,故B错误;
C、R为N元素,其最高价氧化物对应水化物为HNO3,属于强酸,是强电解质,故C错误;
D、Q为C元素,与氢形成的化合物为烃,一定含有C-H,故均含极性共价键,故D正确;
故选D.
本题解析:
本题难度:一般
2、填空题 (每空2分?共16分)?20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;Ⅲ、分子中价层电子对之间的斥力主要顺序为:? i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;? ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;? iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;? iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m
| 2
| ?
| VSEPR理想模型
| ?
| 正四面体
| 价层电子对之间的理想键角
| ?
| 109°28′
|
(2)请用VSEPR模型解释CO2为直线型分子的原因?。
(3) H2O分子的立体构型为:?,请你预测水分子中∠H-O-H的大小范围为?,原因是?。
(4) SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:?。
参考答案:(每空1分,共16分)
(1)
?
4
直线形
?
180°
?
? (2) CO2属AX2E0,n+m=2,故为直线形
(3)? V形?∠H-O-H<109°28′?水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′。根据Ⅲ-i,应有∠H-O-H<109°28′
(4) 四面体
本题解析:(1)如果价层电子对数为2,则n只能是2,m只能是0,所以是直线型结构,其键角是180°。如果分子是正四面体结构,键角是109°28′,则价层电子对数一定是4。
(2)CO2分子中中心原子含有的孤对电子对数是(4-2×2)÷2=0,即不含有孤对电子,CO2属AX2E0,n+m=2,所以CO2分子是直线型结构。
(3)H2O分子中中心原子含有的孤对电子对数是(6-1×2)÷2=2,即水分子是V形结构。由于水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′。根据Ⅲ-i可知,应有∠H-O-H<109°28′。
(4)由于SO2Cl2和SO2F2都属AX4E0型分子,所以n+m=4。又因为双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;所以二者都是四面体形结构,而不是正四面体结构。
本题难度:一般
3、填空题 2013年诺贝尔化学奖授予三位美国科学家,以表彰他们在开发多尺度复杂化学系统模型方面所做的贡献。可以用量子化学计算小区间内(如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有由铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3以外,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有?(不定项选择)。
a.C2H2、C2H4都是非极性分子
b.碳负离子CH3-呈三角锥形
c.NO+电子式为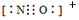 
d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极也可人工合成的二价钒(V)固氮酶(结构如下图)。
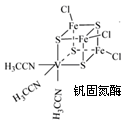
①V2+基态时核外电子排布式为?。
②钒固氮酶钒的配位原子有??(写元素符号)。
③熔融空气电池钒硼晶体晶胞结构如下图所示,该晶胞中含有钒原子数目为?。

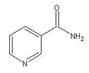
(3)烟酰胺(结构式如图)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有?,1mol该分子中含σ键数目为?。
参考答案:
(1)abc(2分)
(2)①1s22s22p63s23p63d3或[Ar]3d3(2分)。
②S、N (2分,漏写得1分) ③4(2分)。
(3)sp2、sp3(2分,漏写得1分,错写该空为零分);15mol(或15×6.02×1023)(2分)。
本题解析:(1)a、C2H2为直线型,C2H4为平面结构,均对称为非极性分子,正确;b、此离子中碳原子为sp3杂化,为三角锥形,正确;c、NO+与氮气为等电子体,正确;d、前者含有分子间氢键溶沸点高,错误;(2)与钒原子相连有三个硫原子和三个氮原子;
晶胞中顶点8×1/8=1,棱8×1/4=2,面心2×1/2=1,共4个;(3)环上氮原子形成单键和双键为sp2杂化,氨基中氮原子形成单键,为sp3杂化;σ键环上有6个,还有4个碳氢键,共有15个。
本题难度:一般
4、选择题 六氟化硫分子,性质稳定,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是
A.SF6易燃烧生成二氧化硫
B.SF6中各原子均达到 8 电子稳定结构
C.价层电子对数为6,正六面体结构
D.SF6是由极性键构成的非极性分子
参考答案:D
本题解析:略
本题难度:一般
5、填空题 A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,除G外均为前20号元素。A原子基态时p能级原子轨道上电子数等于次外能层电子数,C元素的原子基态时s能级与p能级上的电子数相等,C、D处于相同的能级,且D是同期中电负性最大的元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575,F元素原子中4s能级有2个电子。G元素的离子形成的硫酸盐结晶水合物呈蓝色。
(1)B形成的单质中σ键和Π键的个数比为?,上述元素形成的化合物中和B的单质是等电子体的是__________(填化学式)
(2)G元素的基态原子的电子排布式为 。
(3)常温下,E单质投入到B的最高价氧化物对应的水化物的浓溶液中的现象是 。
(4)D、F组成的晶体FD2结构如图Ⅰ所示,G形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3(硼酸)晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)。
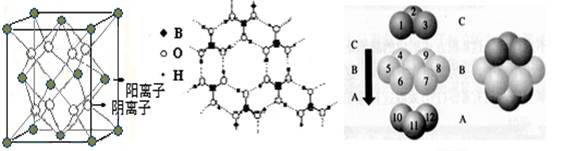
图Ⅰ? ?图Ⅱ? ?图Ⅲ
①图Ⅰ所示的FD2晶体中与F离子最近且等距离的F离子数为?,图Ⅲ中未标号的G原子形成晶体后周围最紧邻的G原子数为?;
②图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是? (写元素符号),H3BO3晶体中B原子个数与极性键个数比为?;
③三种晶体中熔点高低的顺序为? ?(填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为?。
参考答案:(1)1 :2? CO?(2)1s22s22p63s23p63d104s1。?(3)无明显现象(或钝化)?
(4 )①12? 12?②? O? 1∶6?③CaF2 > Cu >H3BO3?分子间作用力(或氢键和范德华力)
本题解析:A原子基态时p能级原子轨道上电子数等于次外能层电子数,且A的原子序数最小,所以A是碳元素。C元素的原子基态时s能级与p能级上的电子数相等,则C是氧元素。由于B的原子序数介于A和C之间,则B是氮元素。C、D处于相同的能级,且D是同期中电负性最大的元素,因此D是F元素。E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575,这说明E位于第ⅢA族元素,因此根据原子序数的大小可知,E应该是Al元素。F元素原子中4s能级有2个电子,且F的原子序数不超过20,所以F是钙元素。G元素的离子形成的硫酸盐结晶水合物呈蓝色,因此G是铜元素。
(1)氮气中含有三键,三键是由1个σ键和2个π键构成的,所以氮气中σ键和Π键的个数比为1 :2。原子数和价电子数分别都相等的是等电子体,则和氮气互为等电子体的是CO。
(2)根据构造原理可知,铜元素的基态原子的电子排布式为1s22s22p63s23p63d104s1。
(3)常温下,铝在浓硝酸中发生钝化想象,所以实验现象是无明显现象(或钝化) 。
(4)①根据晶胞结构可知。图Ⅰ所示的FD2晶体中与F离子最近且等距离的F离子数为(3×8)÷2=12个。铜是面心立方堆积,配位数是12,则G原子形成晶体后周围最紧邻的G原子数为12个。
②在硼酸分子中氢元素和硼元素均不能满足8个电子稳定结构,所以图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是氧元素。在硼酸分子中硼和氧元素之间形成3个极性键,氧元素和氢元素之间铀形成3个极性键,所以H3BO3晶体中B原子个数与极性键个数比为1∶6。
③氟化钙形成的晶体类型是离子晶体,铜形成的晶体类型是金属晶体,硼酸形成的晶体类型是分子晶体,则三种晶体中熔点高低的顺序为CaF2>Cu>H3BO3。硼酸形成的是分子晶体,存在分子间作用力,所以H3BO3晶体受热熔化时,克服的微粒之间的相互作用为分子间作用力(或氢键和范德华力)。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
| 