微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
参考答案:B
本题解析:氨气中心原子氮原子是sp3杂化,含有1对孤对电子,是三角锥形,属于极性分子,A不正确。水中心原子氧原子是sp3杂化,含有2对孤对电子,是V形,属于极性分子,B正确。四氯化碳中心原子碳原子是sp3杂化,没有孤对电子,是正四面体型,属于非极性分子,C不正确。CO2中心原子碳原子是sp杂化,是直线型结构,属于非极性分子,D不正确。答案选B。
本题难度:一般
2、选择题 下列说法正确的是( )
A.过氧化氢的电子式为
B.
I和I2互为同位素
C.质子数为17,中子数为20的氯原子可表示为Cl
D.在Mg18O晶体中,阴离子结构示意图可表示为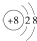
参考答案:A.过氧化氢是共价化合物,两个氧原子之间共用一对电子,过氧化氢的电子式应为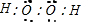 ,故A错误;
,故A错误;
B.12753I2是分子,故B错误;
C.原子左上方的数值应该是质量数,质量数为17+20=37,正确的写法是3717Cl,故C错误;
D.氧离子核外有10个电子,有2个电子层,最外层电子数为8,结构示意图为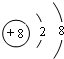 ,故D正确.
,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 下列物质分子的电子式正确的是
[? ]
A.CH3Cl 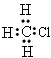
B.羟基 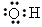
C.CO2 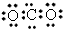
D.C2H4 
参考答案:D
本题解析:
本题难度:简单
4、填空题 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为________,B原子的杂化类型为________。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。图(a)是磷化硼晶体的晶胞示意图,则磷化硼的化学式为________,该晶体的晶体类型是________。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图(b)]。
①硼酸分子中B最外层有________个电子,1 mol H3BO3的晶体中有________mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为________元酸,[B(OH)4]-含有的化学键类型为________。

参考答案:(1)平面三角形 sp2
(2)BP 原子晶体
(3)①6 3 ②一 共价键、配位键
本题解析:(1)BF3分子中,B原子形成了3个σ键,不含孤电子对,故杂化轨道数为3,杂化方式为sp2杂化,BF3分子立体构型为平面三角形。(2)一个晶胞中含有B原子的个数为8×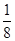 +6×
+6×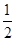 =4个,P原子个数为4个,故化学式为BP;磷化硼晶体中只含共价键且耐磨,为原子晶体。(3)①由图可知,B原子形成了三个共价单键,最外层电子数为6;1 mol H3BO3的晶体中含有3 mol H原子,每个H原子都与相邻的O原子形成氢键,故氢键个数为3 mol;②1 mol B(OH)3·H2O可电离出1 mol H+,故硼酸为一元酸;[B(OH)4]-离子中B原子有一个空的2p轨道,而OH-含有孤电子对,两者之间可以形成配位键。
=4个,P原子个数为4个,故化学式为BP;磷化硼晶体中只含共价键且耐磨,为原子晶体。(3)①由图可知,B原子形成了三个共价单键,最外层电子数为6;1 mol H3BO3的晶体中含有3 mol H原子,每个H原子都与相邻的O原子形成氢键,故氢键个数为3 mol;②1 mol B(OH)3·H2O可电离出1 mol H+,故硼酸为一元酸;[B(OH)4]-离子中B原子有一个空的2p轨道,而OH-含有孤电子对,两者之间可以形成配位键。
本题难度:一般
5、选择题 下列关于分散系的说法正确的是
A.胶体有比较大的比表面积,能吸附离子使胶体带电荷
B.饱和溶液的导电能力一定比不饱和溶液强
C.浓溶液的导电能力一定比稀溶液强
D.胶体具有丁达尔效应
参考答案:D ?
本题解析:A项,胶体微粒具有比较大的比表面积,故能吸附分散系中的离子而使胶体微粒带电荷。B、C项,溶液导电能力的强弱与自由移动的离子浓度有关,而与溶液是否饱和及浓度大小无关。
本题难度:一般