微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( ? )
A.6和8
B.19和16
C.12和17
D.10和8
参考答案:C
本题解析:
本题难度:简单
2、填空题 下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题

(1)f元素在周期表中的位置是第_______周期第________族。
(2)e与f两元素最高价氧化物的水化物相互反应的化学方程式为___________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4)化合物ca3的电子式为____________,c和d两种元素氢化物的稳定性更强的是_______(填物质的化学式)。
参考答案:(1)3;IIIA?
(2)NaOH+Al(OH)3==NaAlO2+2H2O?
(3)离子键;共价键
(4)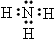 ;H2O
;H2O
本题解析:
本题难度:一般
3、选择题 下列物质中,含有非极性共价键的是
[? ]
A .N2
B .H2O
C .NaOH
D .CH4
参考答案:A
本题解析:
本题难度:简单
4、选择题 已知硼位于元素周期表的第二周期第ЩA族,推测硼的最高价含氧酸的化学式不可能是( )
A.H2BO4
B.H3BO3
C.HBO2
D.H2B4O7
参考答案:A
本题解析:
本题难度:一般
5、填空题 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示.请回答下列问题.
(1)E元素原子基态时的电子排布式为________.
(2)A2F分子中F原子的杂化类型是________,F的氧化物FO3分子空间构型为________.
(3)CA3极易溶于水,试判断CA3溶于水后,形成CA3·H2O的合理结构:________(填字母代号),推理依据是_________________________.
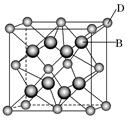
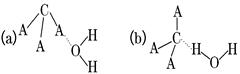
(4)从图中可以看出,D跟B形成的离子化合物;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是______________________(写出表达式即可).
参考答案:(1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2) sp3;平面正三角形? (3)b;一水合氨电离产生铵根离子和氢氧根
(4)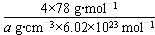 ? (写出表达式即可).
? (写出表达式即可).
本题解析:根据元素的结构及有关性质可知,A、B、C、D、E、F六种元素分别是H、F、N、Ca、Cu、S。
(1)根据构造原理可知,铜元素原子基态时的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
(2)H2S中中心原子含有的孤对电子对数是(6-1×2)÷2=2,所以分子的结构是V形,S原子是sp3杂化;三氧化硫分子中中心原子含有的孤对电子对数是(6-3×2) ÷2=0,所以分子的结构是平面三角形结构。
(3)由于一水合氨在溶液中能电离产生铵根离子和氢氧根离子,所以选项b正确,答案选b。
(4)根据晶胞的结构可知,分子中含有4个钙离子和8个氟离子,所以有 ,即晶胞的羰基是
,即晶胞的羰基是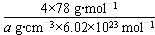 ?。
?。
本题难度:一般