微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
时间
| 0
| 20
| 40
| 60
| 80
| 100
|
c(N2O4)
| 0.100
| c1
| 0.050
| c3
| a
| b
|
c(NO2)
| 0.000
| 0.060
| c2
| 0.120
| 0.120
| 0.120
|
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol?L-1?s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol?L-1。
参考答案:(1)N2O4 2NO2,?60%?(2)0.070?,0.0015? (3)0.2?(每空2分)
2NO2,?60%?(2)0.070?,0.0015? (3)0.2?(每空2分)
本题解析:(1)根据表中数据可知,N2O4是反应物,NO2是生成物,所以该反应的化学方程式为N2O4 2NO2。平衡时NO2的浓度是0.120mol/L,则根据方程式可知消耗N2O4的浓度是0.120mol/L÷2=0.060mol/L,因此NO2的转化率是
2NO2。平衡时NO2的浓度是0.120mol/L,则根据方程式可知消耗N2O4的浓度是0.120mol/L÷2=0.060mol/L,因此NO2的转化率是 。
。
(2)(2)20s时NO2的浓度是0.060mol/L,则消耗N2O4的浓度是0.030mol/L,所以四氧化二氮的浓度c1=0.100mol/L-0.030mol/L=0.070mol/L。则在0~20s时间段内,四氧化二氮的平均反应速率为0.030mol/L÷20s=0.0015_mol?L-1?s-1。
(3)由于N2O4的最初浓度是0.100mol/L,完全转化为NO2时,NO2的浓度应该是0.200mol/L,所以若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为0.200mol/L。
点评:该题是中等难度的试题,试题基础性强,难易适中,侧重对学生基础知识的巩固与训练,有助于培养学生的应试能力,提高学生的学习效率。该题的难点是等效平衡的判断和应用,学生需要明确的是所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较即可。
本题难度:一般
2、选择题 在某一化学反应中,反应物A的浓度在20 s内从1.0 mol/L变为0.2 mol/L,则在这20 s内以A浓度的变化表示的平均反应速率为
A.0.04 mol / (L·s)
B.0.04 mol / L
C.0.08 mol / (L·s)
D.0.08 mol / L
参考答案:A
本题解析:试题分析:反应速率通常用单位时间内浓度的变化量来表示,则以A浓度的变化表示的平均反应速率为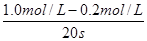 =0.04 mol / (L·s),答案选A。
=0.04 mol / (L·s),答案选A。
考点:考查反应速率的计算
点评:该题是高考中的常见考点,属于常识性知识的考查。该题的关键是明确反应速率的含义以及计算依据,有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:简单
3、选择题 已知:①CO(g)+H2O(g) CO2(g)+H2(g)?ΔH1="-41.2" kJ/mol
CO2(g)+H2(g)?ΔH1="-41.2" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g)? ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g)? ΔH2="+247.3" kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g)?ΔH3
CO(g)+3H2(g)?ΔH3
若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是
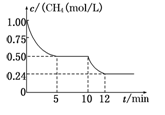
A.ΔH3=+206.1 kJ/mol
B.反应③进行到10 min时,改变的外界条件可能是升高温度
C.反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ
D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大
参考答案:D
本题解析:A、正确,①+②得△H3=-41.2 kJ/mol+247.3 kJ/mol=+206.1 kJ/mol
B、正确,升高温度,平衡正向移动;C、正确,206.1 kJ/mol×0.5mol="103.05" kJ;D、不正确,CH4的转化率将减小。选D。
本题难度:一般
4、选择题 一密闭烧瓶中装有NO2气体,在一定条件下达到化学平衡,现将该烧瓶放在热水中,(?)
A?颜色不变? B 颜色变浅? C 颜色变深? D 无法判断
参考答案:C
本题解析:2NO2(g) N2O4(g)ΔH<0;加热平衡逆向移动,二氧化氮浓度增大,颜色变深。
N2O4(g)ΔH<0;加热平衡逆向移动,二氧化氮浓度增大,颜色变深。
点评:考查平衡移动影响因素;
本题难度:简单
5、选择题 在容积恒定的密闭容器中,存在下列平衡:2HBr(g) H2(g)+Br2(g)-Q,若升高温度,发生改变的是?(?)
H2(g)+Br2(g)-Q,若升高温度,发生改变的是?(?)
A.分子数
B.压强
C.密度
D.平均摩尔质量
参考答案:B
本题解析:2HBr(g) H2(g)+Br2(g)-Q,反应前后,分子数不变,A、不改变;B、升温,压强增大,B、改变;C、反应混合物全是气体,总质量不变,体积不变,密度不变,D、反应混合物全是气体,总质量不变,物质的量不变,平均摩尔质量不变;选B。
H2(g)+Br2(g)-Q,反应前后,分子数不变,A、不改变;B、升温,压强增大,B、改变;C、反应混合物全是气体,总质量不变,体积不变,密度不变,D、反应混合物全是气体,总质量不变,物质的量不变,平均摩尔质量不变;选B。
本题难度:一般