微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。
(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。

参考答案:(1)cd (2分)
(2)正(1分) Cu2++2e?="Cu" (1分)
(3)KNO3 N2 1:5 (共3分,各1分)
(4)5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+ (2分)
本题解析:(1)Na、Mg为活泼金属,无法用还原剂还原化合物制取金属单质,Fe可用还原剂还原化合物制取金属单质,Ag可用加热Ag2O的方法制取Ag,故cd项正确。
(2)电解精炼铜,粗铜为阳极,连接在电源的正极;b极为阴极,电解质溶液中的Cu2+在阴极上得电子,电解方程式为:Cu2++2e?=Cu。
(3)已知X为单质,在反应中NaN3失去电子,可推出X为N2,KNO3中N元素化合价降低,在反应中得电子,所以KNO3为氧化剂;根据氧化反应中氧化剂所得电子总数与还原剂失去电子总数相等,可得n(NaN3)=5n(KNO3),所以氧化剂和还原剂的物质的量之比,即n(KNO3):n(NaN3)=1:5.
(4)根据图示可知,ClO3?把Mn2+氧化为MnO2,可得离子方程式为:5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+
考点:本题考查金属的冶炼、电解精炼铜、氧化还原反应原理及应用、离子方程式的书写。
本题难度:一般
2、填空题 如图,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生 。

(1)外电源的正、负极分别是R为____,S为_____。
(2)A附近溶液的现象是_______,B附近发生的电极反应式为 。
(3)滤纸上的紫色点向哪方移动 (填A或B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为 , 有关的电极反应式为 。
参考答案:(1)负;正;
(2)变红;4OH--4 e-= 2O2↑+H2O;
(3)B;
(4)发生原电池反应,类似与氢氧燃料电池,消耗了氢气和氧气;
本题解析:该图是一个电解池装置,实际电解水,根据图表中产生气体体积的差异,可判断C中为氢气,D中为氧气,则R为负极,S为正极,正极发生电极反应:4OH--4 e-= 2O2↑+H2O,所以A附近溶液变红色。由于电子定向移动从A到B,所以滤纸上的紫色点向B移动。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为发生原电池反应,类似与氢氧燃料电池,消耗了氢气和氧气,有关的电极反应式为负极:2H2-4 e-+4OH- = 4H2O ;正极: 2O2+H2O-4 e- = 4OH-:
考点:电解池原理;原电池
点评:综合考查电解池和原电池知识,灵活性较大,但难度不大,解题的关键要活用电解池及原电池原理,结合装置图,从而找到解题的突破口。
本题难度:一般
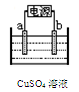
3、选择题 用石墨作电极,电解CuSO4溶液,一段时间后,阴极上只析出铜,要恢复到原浓度,应向溶液中加入
A.Cu(OH) 2
B.Cu
C.CuSO4
D.CuO
参考答案:D
本题解析:电解什么物质加入什么物质,电解CuSO4溶液析出铜产生氧气,加入氧化铜。
本题难度:一般
4、选择题 用铂作电极,电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是( )?
A.AgNO3
B.H2SO4?
C.NaOH
D.NaCl?
参考答案:A.电解AgNO3,阳极析出Ag,阴极生成O2,要使溶液恢复到原来的浓度,应加入Ag2O,故A错误;
B.电解硫酸,阳极生成氧气,阴极生成氢气,实际为电解水,电解后加入水可恢复到原来的浓度,故B正确;
C.电解NaOH,阳极生成氧气,阴极生成氢气,实际为电解水,电解后加入水可恢复到原来的浓度,故C正确;
D.电解食盐水,生成NaOH、H2、Cl2,加盐酸显然不能恢复电解前的状态,应通入适量的HCl气体,故D错误.
故选BC.
本题解析:
本题难度:简单
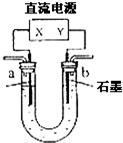
5、选择题 右图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是:( )
| 选项 | 电源X极 | 实验前U形?管中液体 | ?通电后现象及结论
A
正极
Na2SO4溶液
U形管两端滴入酚酞后,a管中呈红色
B
正极
AgNO3溶液
b管中电极反应式是?4OH--4e-=2H2O+O2↑
C
负极
KCl和CuCl2混合溶液
相同条件下,a、b两管中产生的气体总体积可能相等
D
负极
Fe(OH)3胶体和导电液
b管中液体颜色加深
|
A.A
B.B
C.C
D.D