微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如图为相互串联的甲乙两电解池
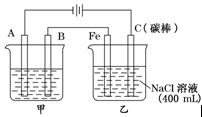
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是?极,材料是?,A电极反应为?。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈?色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为?;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为?。
参考答案:(6分)(1)阳极;粗铜;Cu2++2 e-=Cu ;(2)蓝;(3)2.24L;0.5mol/L
本题解析:(1)甲池中A电极和电源的负极相连,做阴极,B是阳极。甲池若为用电解原理精炼铜的装置,则B是连接粗铜,做阳极。A连接纯铜,溶液中的铜离子放电,电极反应式是Cu2++2 e-=Cu。
(2)乙池中碳棒和电源的正极相连,做阳极,溶液中的氯离子放电生成氯气。铁电极是阴极,溶液中的氢离子放电,生成氢气,所以铁电极周围水的电离平衡被破坏,溶液显碱性,所以电解一段时间后Fe极附近呈蓝色。
(3)若甲池为电解精炼铜,阴极增重6.4g,即析出的铜是6.4g,物质的量是0.1mol,转移0.2mol电子。则根据电子的得失守恒可知,乙池中生成氯气的物质的量是0.2mol÷2=0.1mol,在标准状况下的体积是2.24L。根据反应式2NaCl+2H2O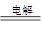 2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.2mol,物质的量浓度是0.2mol÷0.4L=0.5mol/L。
2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.2mol,物质的量浓度是0.2mol÷0.4L=0.5mol/L。
点评:该题是中等难度的试题,试题贴近高考,基础性强,侧重对学生能力的培养。该题的关键是明确电解池的工作原理,特别是电极名称、电极反应式的书写等,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
2、简答题 如图是一种航天器能量储存系统原理示意图.
在该系统中,白天利用太阳能电池(光-电转换装置)将太阳辐射能直接转换为电能,用于白天给航天设备中的用电器供电,并用装置X电解水;夜晚,装置Y中利用白天电解水而贮存的氢气、氧气在KOH溶液中发生电池反应,用于夜晚给航天设备中的用电器供电.
(1)白天,装置X中电解水的化学方程式为______.
(2)夜晚,装置Y中负极的电极反应式为______,正极的电极反应式为______.
(3)有关该系统的下列说法,正确的是______(填选项)
A.该系统中能量的最初来源是太阳能
B.装置X工作时电能完全转化为化学能
C.装置Y中的KOH的物质的量一直保持不变
D.该系统能实现物质的零排放,保护了太空环境.

参考答案:(1)装置X中电解水的化学方程式为:2H2O=2H2↑+O2↑;
故答案为:2H2O=2H2↑+O2↑;
(2)在装置Y中构成燃料电池,化学能转化为电能,作用于马达实现了电能与机械能的转化,氢氧燃料电池的负极上应是H2参加反应,氢气失电子发生氧化反应电解反应为:2H2+4OH--4e-=4H2O,正极是氧气参加反应,氧气得到电子发生还原反应,电解反应为:O2+2H2O+4e-=4OH-;
故答案为:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-
(3)A.装置X和Y实际上是存储了部分太阳能电池产生的电能,太阳能电池利用光能转化为电能可直接用于工作;马达实现了电能与机械能的转化;该系统中能量的最初来源是太阳能,故A正确;
B.在装置X中,电解水生成H2、O2,实现了电能与化学能的转化;但装置X工作时电能不能完全转化为化学能,故B错误;
C.装置Y中的电极反应为:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-,依据电极反应可知过程中的KOH的物质的量一直保持不变,故C正确;
D.系统工作中是太阳能转化为电能,电能转化为化学能,过程中是水的转化反应关系应用,该系统能实现物质的零排放,保护了太空环境,故D正确;
故答案为:ACD;
本题解析:
本题难度:简单
3、选择题 如图是工业上采用离子交换膜法电解足量饱和食盐水的示意图。下列有关说法中不正确的是:?

A.从E口逸出的是氢气
B.向B口中加入含少量NaOH 的溶液以增强导电性
C.标准状况下每生成22.4LCl2,便产生2molNaOH
D.向电解后的阳极室溶液中加入适量盐酸,各物质可以恢复到电解前的浓度
参考答案:D
本题解析:略
本题难度:一般
4、填空题 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
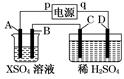
(1)p为?极,A极发生了?反应。
(2)C为?极,可收集到?;D为?极,可收集到?。
(3)C极的电极反应式为?。
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表:
时间(min)
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 10
|
阴极产生气体
的体积(cm3)
| 6
| 12
| 20
| 29
| 39
| 49
| 59
| 69
| 79
| 89
|
阳极产生气体
的体积(cm3)
| 2
| 4
| 7
| 11
| 16
| 21
| 26
| 31
| 36
| 41
|
?
仔细分析以上实验数据,请说出变化的可能原因是
?。
(5)当反应进行一段时间后,A、B电极附近溶液的pH?(填“增大”“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为?。
参考答案:(1)正 氧化
(2)阳 氧气 阴 氢气
(3)4OH--4e-=O2↑+2H2O
(4)在开始反应的1~4 min内,由于生成的氧气和氢气在水中的溶解没有达到饱和,氧气的溶解度大于氢气,故氢气和氧气的体积比大于2∶1;随着反应的进行,到4 min后,由于生成的氧气和氢气在水中的溶解均达到饱和,故体积比约等于2∶1
(5)不变
(6)64 g/mol
本题解析:(1)B极:X2++2e-=X因此B为阴极,由此可推知A是阳极。C是阳极,D是阴极,p为正极。
(4)从O2和H2在水中的溶解度大小回答。
(5)中A极:X-2e-=X2+,B极:X2++2e-=X,故两极pH不变。
(6)设X的摩尔质量为M,则:
X2++2e-=? X
2 mol?M
0.004 mol? 0.128 g
M=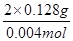 =64 g/mol。
=64 g/mol。
本题难度:一般
5、填空题 (10分)在下图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极。

(1)断开K2接通K1时,a为_________极,b电极上的电极反应式为___________________
(2)断开K1接通K2时,a为__________极,该电极上的电极反应式为____________________,一段时间后,溶液的pH_________________(填“增大”,“减小”或“不变”)
参考答案:(1)负,2H++2e-=H2↑;(2)阳,Fe-2e-=Fe2+ 增大。
本题解析:(1)断开K2接通K1时,该装置是原电池,则Fe与稀硫酸发生反应,Fe作负极,所 以 a是负极;b极发生还原反应,氢离子得到电子生成氢气,电极反应式为2H++2e-=H2↑;
(2)断开K1接通K2时,a为电源的正极相连,所以s为阳极,阳极发生氧化反应,Fe失去电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+;b极是阴极,发生还原反应,氢离子得到电子生成氢气,所以一段时间后,氢离子浓度减小,pH增大。
考点:考查电化学反应原理的应用,电化学装置的判断,电极反应式的书写
本题难度:一般