微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)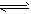 CO2(g)+H2(g),得到如下三组数据
CO2(g)+H2(g),得到如下三组数据
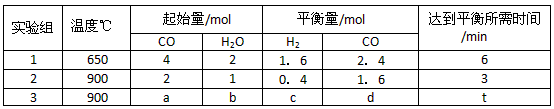
①实验1中以v(CO2)表示的反应速率为_______(取二位小数,下同)。
②该反应为_______(填“吸”或“放”)热反应,实验2条件下平衡常数K=_______。
(3)已知在常温常压下:
① 2CH3OH(l) +3O2(g) =2CO2(g) +4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO(g)+ O2(g) =2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) =H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
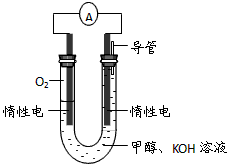
①该电池正极的电极反应为_____________________。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为_____________________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与
Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为_____________。
参考答案:(1)5、4、6、5、4、2、6
(2)①0.13mol/(L·min);②放;0.17
(3)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-442.8 kJ∕mol?
(4)①O2+2H2O+4e-=4OH-;②2CH3OH+3O2+4OH-=2CO32-+6H2O
(5)5.6×10-5 mol/L
本题解析:
本题难度:困难
2、选择题 在铜一锌一硫酸构成的原电池中,当导线中有1mol电子通时,理论上的两极变化是
①锌片溶解32.5g? ②锌片增重32.5g ③铜片上析出1 gH2 ④铜片上析出1mol H2
A.①③
B.①④
C.②③
D.②④
参考答案:A
本题解析:
分析:锌-铜-稀硫酸组成的原电池装置中,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答:解:该原电池放电时,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电池反应式为
Zn+H2SO4=ZnSO4+H2↑.
设当导线中有1mol电子通过时,理论上负极锌片溶解x,铜片上析出氢气y.
Zn+H2SO4=ZnSO4+H2↑?转移电子
65g? 2g? 2mol
x? y? 1mol
x=32.5g?
y=1g
故选A.
点评:本题以原电池原理为载体考查了物质的量的有关计算,难度不大,根据电池反应式计算即可.
本题难度:一般
3、选择题 某原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,此反应的原电池的正确
?
| 正极
| 负极
| 电解质溶液
|
A
| Cu
| Zn
| CuCl2
|
B
| Zn
| Cu
| H2SO4
|
C
| Cu
| Zn
| CuSO4
|
D
| Cu
| Zn
| ZnCl2
参考答案:AC
本题解析:考查原电池的判断。原电池中较活泼的金属作负极,失去电子,发生氧化反应。不活泼的金属作正极。根据总反应式可判断,锌是还原剂,铜离子得到电子,被还原,发生还原反应。所以正确的答案是AC。
本题难度:一般
4、选择题 如图所示为铜锌原电池,下列有关说法不正确的是( )
A.锌片作负极
B.铜片上有气泡
C.电子由铜片经导线流向锌片
D.一段时间后,溶液中氢离子的物质的量减小
|
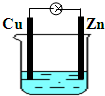
参考答案:A.该装置中锌易失电子作负极,故A正确;
B.铜作正极,正极上氢离子得电子生成氢气,所以Cu上有气泡生成,故B正确;
C.电子从负极沿导线流向正极,即电子从负极锌沿导线流向正极铜,故C错误;
D.正极上氢离子得电子发生还原反应生成氢气,所以一段时间后,溶液中氢离子的物质的量减小,故D正确;
故选C.
本题解析:
本题难度:简单
5、选择题 某原电池结构如图所示,下列有关该原电池的说法正确的是
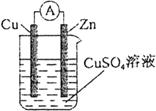
A.铜棒为负极
B.锌棒发生还原反应
C.电子从铜棒经外电路流向锌棒
D.锌棒质量减轻
参考答案:D
本题解析:较活泼的锌电极失电子,发生氧化反应,经导线流向正极铜,溶液中的铜离子得电子,发生还原反应。
本题难度:一般