微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。指出电解质溶液是__________,正极电极反应式为__________________。
(3)写出甲醇(CH3OH)—空气碱性燃料电池(KOH作为电解质溶液)的负极反应式:_______________________________。
参考答案:(1)2Fe3++Cu=2Fe2++Cu2+;(2分)
(2)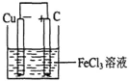 (2分) ;
(2分) ;
FeCl3(1分); 2Fe3++2e—=2Fe2+。(2分)
(3) CH3OH-6e-+8OH-=CO32-+6H2O (3分)
本题解析:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,故答案为:
,故答案为: ;Cu-2e-=Cu2+;
;Cu-2e-=Cu2+;
Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)。
(3)甲醇是负极,失去电子,电极式为CH3OH-6e-+8OH-=CO32-+6H2O。
考点:盐和亚铁盐的相互转变 电极反应和电池反应方程式.
点评:本题考查了原电池的工作原理及原电池的设计,难度较大,原电池的设计是学习的重点和难度。
本题难度:一般
2、选择题 已知Fe2+可用K3Fe(CN)6来检验(呈蓝色).将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图II示)发生了变化.则下列说法正确的是( )
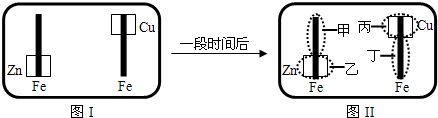
A.甲区不变色
B.乙区呈现蓝色
C.丙区产生Cu2+离子
D.丁区产生Fe2+离子
参考答案:A、甲区发生电极反应:O2+2H2O+4e-=4OH-,生成的氢氧根离子能使酚酞变红色,所以甲极区变红色,故A错误;
B、乙区发生电极反应:2Zn-4e-=2Zn2+,所以乙极区不变色,故B错误;
C、丙区发生电极反应:O2+2H2O+4e-=4OH-,不会产生铜离子,故C错误;
D、丁区发生电极反应:2Fe-4e-=2Fe2+,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 将铝片和铜片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
D.铜片、铜片
参考答案:A
本题解析:铝在浓硝酸中发生钝化,所以如果电解质是浓硝酸,则铝是正极,铜是负极;如果电解质是氢氧化钠溶液,由于铝能和氢氧化钠溶液反应,所以此时铝是负极,铜是正极,答案选A。
点评:该题是中等难度的试题,试题注重解题的灵活性,侧重能力的培养,有利于培养学生的灵活应变能力,提高学生分析问题、关键是灵活运用基础知识解决实际问题的能力。
本题难度:一般
4、简答题 铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸.电池总反应式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O请回答下列问题:
(1)放电时:负极的电极反应式是______;电解液中H2SO4的浓度将变______;当外电路通过2mol电子时,理论上负极板的质量增加______g.
(2)在完全放电耗尽PbO2和Pb时,若按如图连接,电解一段时间后,则在A电极上生成______、在B电极上生成______.
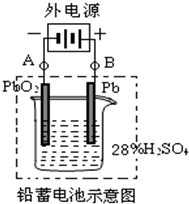
参考答案:(1)电池总反应式为:Pb+PbO2+4H++2SO42-放电
本题解析:
本题难度:一般
5、填空题 根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示,其中盐桥为琼胶?饱和KNO3盐桥。请回答下列问题。? ( )
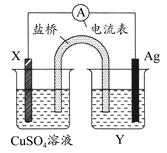
(1)电极X的材料是________,电解质溶液Y是________。
(2)银电极为电池的________极,写出两电极的电极反应式:
银电极:_________________________________________________;
X电极:___________________________________________________。
(3)外电路中,电子是从________电极流向________电极。
参考答案:(1)铜(或Cu);AgNO3溶液 (2)正;Ag++e-=Ag;Cu-2e-=Cu2+ (3)Cu;Ag
本题解析:该题考查原电池的基本原理,根据所给反应的设计要求并结合所给装置可看出:X极是Cu,电解质溶液Y为AgNO3溶液,因为Cu比Ag活泼,所以Cu为负极,Ag为正极,电极反应式分别为:负极:Cu-2e-=Cu2+,正极:Ag++e-=Ag,在外电路,电子由负极Cu流向正极Ag。
本题难度:一般