|
高中化学必备知识点《化学反应与能量》答题技巧(2017年最新版)(二)
2017-07-18 01:11:26
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是 ( )
A.酸碱中和反应是吸热反应
B.吸热反应不加热 就不会发生 就不会发生
C.放热反应不用加热也一定能发生
D.反应是放热还是吸热可以看反应物和生成物所具有的总能量的相对大小
|
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列反应的离子方程式正确的是
A.CuSO4溶液吸收H2S气体:
B.Ca(HCO3)2溶液和少量的NaOH溶液混合:→CaCO3↓+
C.硫酸亚铁溶液中加入用硫酸酸化的过氧 化氢溶液:Fe2++2H++H2O2→Fe2++2H2O
D.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O→
参考答案:AD
本题解析:分析:A.反应生成CuS和硫酸;
B.少量的NaOH溶液完全反应,反应生成碳酸钙、水、碳酸氢钠;
C.发生氧化还原反应生成硫酸铁和水;
D.发生氧化还原反应生成碘和KOH.
解答:A.CuSO4溶液吸收H2S气体的离子反应为Cu2++H2S═CuS↓+SO42-,故A正确;
B.Ca(HCO3)2溶液和少量的NaOH溶液混合的反应为Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液的离子反应为2Fe2++2H++H2O2═2Fe3++2H2O,故C错误;
D.淀粉碘化钾溶液在空气中变蓝的离子反应为4I-+O2+2H2O═I2+4OH-,故D正确;
故选AD.
点评:本题考查离子反应的书写,明确发生的化学反应把握化学反应的实质是解答的关键,侧重氧化还原反应的离子反应考查,题目难度不大.
本题难度:一般
3、简答题 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
| K+
| Na+
| N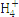
| S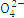
| N
| Cl-
| 浓度/mol·L-1
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ① O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①
C(s)+ O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ② O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) ΔH>0 2NO(g) ΔH>0
若1 mol空气含0.8 mol N2和0.2 mol O2,1 300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g) 2C(s)+O2(g)
已知该反应的ΔH>0,简述该设想能否实现的依据:
。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
参考答案:(1)酸性 4
(2)①C(s)+ H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol
②a、b
(3) ①4×10-6 温度升高,反应速率加快,平衡右移
②该反应是焓增、熵减的反应,任何温度下均不自发进行
③2CO+2NO 2CO2+N2 2CO2+N2
本题解析:(1)根据电荷守恒规律得c(Cl-)+ c(NO3-)+2 c(SO42-)= c(K+)+ c(Na+)+c(NH4+)+ c(H+),计算可得c(H+)=1×10-4mol/L,pH="4," PM2.5的酸碱性为酸性;
(2)①根据盖斯定律可得焦炭与水蒸气反应的热化学方程式=②-①,所以答案是C(s)+ H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol;
②二氧化硫可与氢氧化钙、碳酸钠溶液反应,但不与氯化钙、亚硫酸氢钠溶液反应,所以作洗涤剂的是氢氧化钙、碳酸钠,答案选ab;
(3)①N2(g)+O2(g) 2NO(g)ΔH>0,开始时0.8 mol N2和0.2 mol O2,达到平衡, NO为8×10-4mol。根据化学方程式可计算出平衡时氮气、氧气的物质的量分别为0.7996mol、0.1996mol,NO的系数是2,所以化学平衡常数K=c(NO)2/c(N2)c(O2)=n(NO)2/n(N2)n(O2)= (8×10-4mol)2/0.7996mol×0.1996mol=4×10-6;该反应是吸热反应,温度越高,反应速率越快,对正反应有利,NO的排放量越大; 2NO(g)ΔH>0,开始时0.8 mol N2和0.2 mol O2,达到平衡, NO为8×10-4mol。根据化学方程式可计算出平衡时氮气、氧气的物质的量分别为0.7996mol、0.1996mol,NO的系数是2,所以化学平衡常数K=c(NO)2/c(N2)c(O2)=n(NO)2/n(N2)n(O2)= (8×10-4mol)2/0.7996mol×0.1996mol=4×10-6;该反应是吸热反应,温度越高,反应速率越快,对正反应有利,NO的排放量越大;
②从方程式上判断,该反应是焓增、熵减的反应,任何温度下均不自发进行;
③汽车尾气系统中装置催化转化器,目的是把有毒气体转化为无毒气体二氧化碳、氮气,所以化学方程式为2CO+2NO 2CO2+N2 2CO2+N2
考点:考查电荷守恒规律的应用,溶液pH的计算,盖斯定律的应用,化学平衡常数的计算,反应自发的判断,化学方程式的书写
本题难度:困难
4、填空题 (5分)某实验小组同学进行如下实验,以探究化学反应中的能量变化。
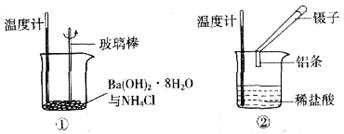
(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是____________(填“吸热”或“放热”)反应。
(2)实验②中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是____________(填“吸热”或“放热”)反应,其能量变化可用下图中的____________(填“B”或“C”)表示。
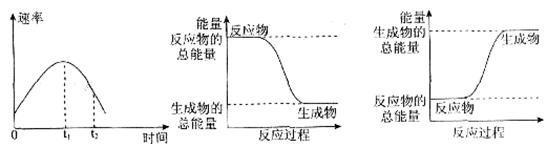
图A中0一tl段化学反应速率变化的原因是_________________________________。
参考答案:(1)吸热,(2)放热,B;反应放热,随反应进行,温度升高,化学反应速率加快。
本题解析:(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是吸热反应;(2)实验②中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是放热反应;则反应物的能量高, 的能量低,其能量变化可用图中的B表示;图A中0一tl段化学反应速率变化的原因是反应放热,使溶液的温度升高。随反应进行,温度升高,化学反应速率加快。
考点:考查化学反应热效应变化、反应热与物质含有能量的关系、物质化学反应速率的原因及图像法表示。
本题难度:一般
5、选择题 下列离子方程式书写正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O
B.稀盐酸与氢氧化钡溶液反应:H++OH-═H2O
C.硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓
D.铁与稀硫酸溶液反应:2Fe+6H+═2Fe3++3H2↑
参考答案:B
本题解析:分析:A.大理石在离子反应中保留化学式;
B.反应生成氯化钡和水;
C.漏写生成氢氧化镁的离子反应;
D.反应生成硫酸亚铁和氢气.
解答:A.实验室用大理石和稀盐酸制取CO2的离子反应为2H++CaCO3═CO2↑+H2O+Ca2+,故A错误;
B.稀盐酸与氢氧化钡溶液反应的离子反应为H++OH-═H2O,故B正确;
C.硫酸镁溶液与氢氧化钡溶液反应2OH-+Mg2++SO42-+Ba2+═BaSO4↓+Mg(OH)2↓,故C错误;
D.铁与稀硫酸溶液反应的离子反应为Fe+2H+═Fe2++H2↑,故D错误;
故选B.
点评:本题考查离子反应的书写,明确发生的化学反应是解答的关键,注意离子反应的书写方法,学生容易漏写离子反应,题目难度中等.
本题难度:简单
|  O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①
O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ① O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ② 2NO(g) ΔH>0
2NO(g) ΔH>0