微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,将浓度为0.1mol·L-1的醋酸溶液加水稀释10倍,浓度变化最大的微粒是
A.CH3COO-
B.H+
C.OH-
D.CH3COOH
参考答案:D
本题解析:醋酸溶液中存在如下电离平衡 ?
?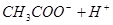 ,加水稀释,假设平衡不移动,则溶液中各粒子浓度变化倍数相同,但加水稀释平衡向右移动,所以醋酸分子浓度再次减少,即正确选项为D;
,加水稀释,假设平衡不移动,则溶液中各粒子浓度变化倍数相同,但加水稀释平衡向右移动,所以醋酸分子浓度再次减少,即正确选项为D;
本题难度:一般
2、选择题 下列关于盐酸与醋酸两种稀溶液的说法正确的是? (?)?
A.相同浓度的两溶液中c(H+)相同
B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PH
D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小
参考答案:BC
本题解析:因为醋酸溶液中存在电离平衡,所以相同浓度的两溶液c(H+)不同?,A错;B项两溶液中含溶质的物质的量相同所以能中和等量的氢氧化钠,B对;C项醋酸被稀释是平衡右移,pH变化小,正确;D项当加入少量钠盐盐酸中c(H+)不变,而CH3COO-会抑制醋酸的电离,导致c(H+)减小。
本题难度:一般
3、选择题 在已达到电离平衡的0.1 mol·L一的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是? (? )
A.加少量盐酸
B.加热
C.加少量醋酸钠晶体
D.加氢氧化钠
参考答案:B
本题解析:A、加入少量盐酸,H+浓度增大,醋酸的电离平衡向左移动,错误;B、因为弱酸的电离吸热,所以加热使醋酸的电离平衡向右移动,H+浓度增大,pH降低,正确;C、加入少量醋酸钠晶体,平衡向左移动,H+浓度减小,pH增大,错误;D、加入NaOH,中和CH3COOH,H+减小,pH增大,错误。
本题难度:一般
4、选择题 下列说法不正确的是( )
A.Na2CO3溶液中c(OH-)大于c(HCO)
B.水的离子积常数为KW,若溶液中c2(OH-)=KW,溶液pH可能小于7
C.1 mol/L的CH3COOH溶液加水稀释时,溶液中某种离子浓度可能增大
D在CH3COOH溶液中加入溶于水溶液呈碱性的固体物质,平衡一定向电离方向移动
参考答案:D
本题解析:Na2CO3溶液中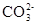 发生水解产生OH-和HCO但是HCO会继续水解生成碳酸和OH-,所以溶液中c(OH-)大于c(HCO),A正确;KW与温度有关,当温度是25℃时KW=10-14若
发生水解产生OH-和HCO但是HCO会继续水解生成碳酸和OH-,所以溶液中c(OH-)大于c(HCO),A正确;KW与温度有关,当温度是25℃时KW=10-14若
c2(OH-)=KW,常温下可以得到pH=7,但是当温度低于25℃时,KW<10-14,所得的pH小于7,所以B正确;1 mol/L的CH3COOH溶液加水稀释时溶液的酸性逐渐减弱,溶液中氢离子的浓度逐渐减小,氢氧根的浓度逐渐增大,C正确;加入溶于水溶液呈碱性的固体物质可能是碱也可能是水解显碱性的盐,如CH3COONa,若加入的物质是CH3COONa,加入了CH3COO-抑制电离电离平衡向电离方向的反方向移动,D错误;所以答案选D
本题难度:一般
5、选择题 下列说法中,正确的是
A.强电解质的水溶液一定比弱电解质的水溶液的导电能力强
B.强电解质都是离子化合物,弱电解质都是共价化合物
C.强电解质的水溶液中不存在溶质分子
D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质
参考答案:C
本题解析:A、若强电解质溶液中离子浓度很小,而弱电解质溶液中离子浓度大,则弱电解质溶液的导电能力强,错误;B、有些强电解质是共价化合物,如HCl、HNO3、H2SO4等,错误;C、强电解质溶于水时完全电离,所以水溶液中不存在溶质分子,正确;D、有些不溶性盐如BaSO4、CaCO3属于强电解质,有些可溶性酸如H3PO4、H2SO3等属于弱电解质,有些具有极性键的化合物是弱电解质如氟化氢,有些具有极性键的化合物是非电解质如二氧化碳,错误。
本题难度:一般