微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)工业上用MnO2为原料制取KMnO4,主要生产过程分为两步进行:第一步将MnO2和KOH、粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,两极发生的电极反应式:
阴极是??,阳极是??;
电解的总反应方程式是?。
参考答案:
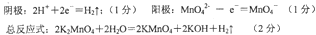
本题解析:
由题意在阳极上得到KMnO4,在阴极上得到KOH,阴极是水的电离平衡被破坏,阴极:2H2O?+2e―=H2+2OH― ;阳极:MnO42――e―=MnO42―
总反应:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑
本题难度:一般
2、选择题 pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的pH仍相同,则m和n的关系是
[? ]
A. m = n
B. m> n
C. m<n
D. 无法判断
参考答案:B
本题解析:
本题难度:一般
3、选择题 H2S的水溶液中存在平衡:H2S  HS-+ H+和HS-
HS-+ H+和HS- S2-+H+,当增大溶液的pH时, c(S2-)怎样变化
S2-+H+,当增大溶液的pH时, c(S2-)怎样变化
A增大 B、减小 C、不变 D、可能增大也可能减小
参考答案:D
本题解析:当增大溶液的pH的方法有多种,当通过加入碱来增大溶液的pH时,平衡向正向移动,c(S2-)会增大,如果稀释溶液,酸性会减弱,碱性增强,pH增大,此时c(S2-)减小,故c(S2-) 可能增大也可能减小,选D。
考点:电离平衡的移动的影响因素和溶液的pH变化。
本题难度:一般
4、选择题 正常人体血液的pH________7
A.>
B.<
C.=
D.不能确定
参考答案:A
本题解析:
本题难度:简单
5、填空题 (6分)写出下列物质在水溶液中的电离方程式或离子水解方程式。
1、写出下列三种物质的电离方程式
(1) HClO 。
(2)CH3COONa 。
(3)NH3·H2O 。
2、写出下列三种物质的离子水解方程式
(4)CH3COONa 。
(5)NH4Cl 。
(6)NaF 。
参考答案:(6分)(每小题1分)(1) HClO  H+ + C lO-
H+ + C lO-
(2) CH3COONa =CH3COO- + Na+ (3) NH3·H2O  NH4+ + OH-
NH4+ + OH-
(4) CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
(5) NH4+ + H2O  NH3·H2O + H+ (6) F- + H2O
NH3·H2O + H+ (6) F- + H2O  HF + OH-
HF + OH-
本题解析:醋酸钠是强电解质,用等号连接,次氯酸和氨水都是弱电解质,用可逆号连接,因此正确的电离方程式是(1) HClO H+ + ClO-;(2) CH3COONa =CH3COO- + Na+ ;(3) NH3·H2O
H+ + ClO-;(2) CH3COONa =CH3COO- + Na+ ;(3) NH3·H2O  NH4+ + OH-;醋酸钠和氟化钠都是强碱弱酸盐,水解显碱性。氯化铵是强酸弱碱盐,水解显酸性。由于水解都是可逆的,所以水解方程式分别是(4) CH3COO- + H2O
NH4+ + OH-;醋酸钠和氟化钠都是强碱弱酸盐,水解显碱性。氯化铵是强酸弱碱盐,水解显酸性。由于水解都是可逆的,所以水解方程式分别是(4) CH3COO- + H2O  CH3COOH + OH-;(5) NH4+ + H2O
CH3COOH + OH-;(5) NH4+ + H2O  NH3·H2O + H+;(6) F- + H2O
NH3·H2O + H+;(6) F- + H2O  HF + OH-。
HF + OH-。
考点:考查电离方程式和水解方程式的书写
点评:书写电离方程式时首先要判断电解质的强弱,然后在依据具体的电解质书写;而水解方程式的书写,则需要注意水解反应一般都是可逆的,其次还要注意多元弱酸根以及多元弱碱离子的不同。再就是水解的程度一般都很小,一般不能标出“↑”或“↓”。
本题难度:一般