微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,用水稀释0.1mol·L-1的一元弱酸HA,随稀释进行,下列数值一定增大的是(Kw表示水的离子积,Ka表示HA的电离常数)
[? ]
A.Kw
B.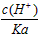
C.
D.c(OH-)
参考答案:D
本题解析:
本题难度:一般
2、选择题 室温下pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
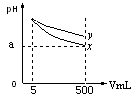
A.稀释后x溶液中水的电离程度比y溶液中水电离程度小
B.若x、y是一元碱,室温下pH=11的x、y两种碱溶液的浓度相同
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
参考答案:C
本题解析:x线pH下降快,说明碱性:x>y;A:稀释后y的碱性相对强,对水的电离抑制程度相对大,水的电离程度相对小;B:两碱的电离度不同,由c(OH—)=c×α可知,两者的浓度不同;C:选项正确;D:其中y碱性相对弱,其电离度小,浓度相对大,同体积的两碱溶液,y消耗酸多。
本题难度:一般
3、简答题 (1)物质的量浓度相同的三种盐NX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是______.
(2)比较下列溶液的pH(填“>”“<”或“=”):
①0.1mol?L-1Na2CO3溶液______0.1mol?L-1NaHCO3溶液
②0.1mol?L-1NH4Cl溶液______0.01mol?L-1NH4C1溶液
(3)把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池.若a、b相连,a为负极;c、d相连,c为负极;a、c相连,c为正极;b、d相连,b为正极,则这四种金属的活动性由强到弱的顺序为______.
(4)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是______.
(5)氯化铁溶液呈性(填“酸”、“碱”或“中”),原因是(用离子方程式表示):______.
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,溶液的pH7(填“>”“<”或“=”),离子反应总方程式为:______.
参考答案:(1)因pH越大,其盐溶液碱性越强,说明酸根离子水解越是强烈,对应的酸越弱,所以HX、HY、HZ的酸性由强到弱的顺序:HX>HY>HZ;
故答案为:HX>HY>HZ;
(2)①Na2CO3的水解程度大于 NaHCO3,所以0.1mol?L-1Na2CO3溶液的PH大于0.1mol?L-1NaHCO3溶液的PH,故答案为:>;
②NH4C1浓度越大,水解生成的氢离子浓度越大,溶液的PH越小,所以0.1mol?L-1NH4Cl溶液的PH小于0.01mol?L-1NH4C1溶液的PH,故答案为:<;
(3)两种不同的金属和稀硫酸构成的原电池中,较活泼易失电子的金属作负极,较不活泼金属作正极,负极上金属被腐蚀,正极上氢离子得电子生成氢气,
a、b相连,a为负极,则金属活动性顺序a>b;
c、d相连时,c为负极,则金属活动性顺序c>d;
a,c相连时,c为正极,则金属活动性顺序a>c;
b、d相连时,b为正极,则金属活动性顺序d>b,
根据以上分析知,金属活动性顺序为a>c>d>b;
故答案为:a>c>d>b;
(4)AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3;故答案为:Al2O3;
(5)FeCl3为强酸弱碱盐,Fe3+离子水解使溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(6)假设SO42-的物质的量为2mol,则明矾溶液中含有2mol SO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,反应后溶液呈碱性,pH>7,
故答案为:>;Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
本题解析:
本题难度:一般
4、选择题 醋酸溶液中存在电离平衡CH3COOH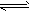 H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
[? ]
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.升高温度,醋酸溶液的pH值变小
参考答案:B
本题解析:
本题难度:一般
5、选择题 当CH3COOH 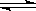 CH3COO-+H+达到平衡时,若要使醋酸的电离程度和溶液的pH都增大,应加入的试剂是
CH3COO-+H+达到平衡时,若要使醋酸的电离程度和溶液的pH都增大,应加入的试剂是
A.NH3·H2O
B.HCl
C.CH3COONa
D.NaCl
参考答案:A
本题解析:A正确,加入NH3·H2O,与H+反应使平衡向右移动,即电离程度增大,同时,加入了碱中和了酸,溶液的酸性减弱,PH增大;B错,加入HCL,抑制醋酸的电离,且溶液的酸性增强,PH减小;C错,加入?CH3COONa?抑制醋酸电离,溶液的PH增大;D错,加入NaCl,平衡不移动,溶液的PH不变;
本题难度:一般