微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)
(1)在我国使用最早的合金是?,目前用量最大,用途最广泛的合金是?。
(2)0.5 mol H2O 的质量为?g,共有?个原子。
(3)质量都是50g 的Cl2、NH3、CO2、O2四种气体中,含有分子数最少的是?;在相同的温度和压强下,体积最大的是?。
(4)配制50mL 0.2mol/L CuSO4溶液,需要CuSO4?5H2O ?g。
(5)氯气可用于自来水的杀菌、消毒,请用化学方程式和简要的文字说明理由:
?。
参考答案:(1)青铜(或铜合金、铜)?钢(或铁合金、铁)?(每个空1分)
(2)9? 9.03×1023(或1.5×6.02×1023、1.5NA)?(每个空2分)
(3)Cl2? NH3?(每个空2分)
(4)2.5?(2分)
(5)只要答出: Cl2 + H2O =" HCl" + HClO ,? HClO具有强氧化性这两点即给满分
(2分。化学方程式和文字说明各1分)
本题解析:略
本题难度:简单
2、填空题 我国从澳大利亚进口的某高炉生铁(用A表示)的成分如下(其余是铁):
C
| Si
| Mn
| P
| S
|
4.070%
| 2.900%
| 0.495%
| 0.165%
| 0.010%
|
(1)称取100.000g A经过一系列处理(最后一步是在空气中灼烧)后,锰全部转变为某种氧化物,其质量为0.687g,则其化学式为?。
(2)磷肥的肥效以相当含P2O5多少来表示。炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质]。若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数至少是?%。
(3)锰的质量分数为30%的高锰钢有很好的性能,可制作火车车轮。将A冶炼成含碳0.4%、含锰30%的高锰钢(设铁无损耗,其它杂质已除去,可补充锰),则100吨A可制得高锰钢?吨。
(4)某炼钢厂的烟尘成分和质量分数如下表:
?
| FeO
| Fe2O3
| CaO
|
烟尘煅烧前(%)
| 86.40
| 4.00
| 9.60
|
?
为了减少烟尘的排放,将烟尘与CO混合后在空气中煅烧,得到铁的氧化物和CaO的烧结物,其中CaO的质量分数为8.92%(金属元素无损耗),烧结物分离出CaO后,若铁的氧化物中只有两种物质组成,则铁的氧化物的组成和物质的量之比如何?
参考答案:(1)Mn3O4(2分)
(2) 27.46
(3)132.701(3分)
(4)反应后固体混合物中 n(Fe):n(O)=1:1.4
①若是FeO和Fe2O3的混合物,则它们的物质的量之比为1:2;
②若是Fe3O4和Fe2O3的混合物,则它们的物质的量之比为1:1;
本题解析:(1)100.000g A含有Mn的质量=100.000g×0.495%=0.495g,所得MnxOY中O元素的质量=0.687g-0.495g=0.192g,则:x:y="0.495/55" :0.192/16=3:4,故该氧化物的化学式为Mn3O4,故答案为:Mn3O4;
(2)将Ca(H2PO4)2改写CaH4O3?P2O5,含P2O5的质量分数═45.25%×142/234=27.46%,普钙中还可能还有Ca3(PO4)2,所以用P2O5表示的质量分数还可能大于27.46%,故P2O5的质量分数≥27.46%,故答案为:≥27.46%;
(3)令可以生成高锰钢y吨,根据Fe元素质量不变,则:y×(1-30%-0.4%)=100×(1-4.070%-2.9%-0.495%-0.165%-0.010%)解得:y=132.701,故答案为:132.701;
(4)假设烟尘煅烧前烟尘的质量为100g,则n(FeO)=1.2mol,n(Fe2O3)=0.025mol,Fe元素物质的量=1.2mol+0.05mol=1.25mol,其质量=1.25mol×56g/mol=70g,烟尘煅烧前后Fe元素的质量不变.煅烧后CaO的质量也不变,煅烧后物质的质量=100*9.6%/8.92%=107.6g,其中O元素的质量=107.6g×(1-8.92%)-70g=28.0g,n(O)=28/16=1.75mol,反应后固体混合物中?n(Fe):n(O)=1.25mol:1.75mol=1:1.4,故烟尘煅烧后铁的氧化物的平均组成为FeO1.4。铁的常见氧化物有FeO、Fe2O3、Fe3O4,①若是FeO和Fe2O3的混合物,令FeO和Fe2O3的分别为xmol、ymol,则(X+3Y)/(X+2Y)=1.4,整理得x:y=1:2,故FeO和Fe2O3的物质的量之比为1:2;②若是Fe3O4和Fe2O3的混合物,令Fe3O4和Fe2O3的xmol、ymol,则(4X+3Y)/(3X+2Y)=1.4,整理得x:y=1:1,故Fe3O4和Fe2O3的物质的量之比为1:1;③若是FeO和Fe3O4的混合物,不符合平均组成,不合理;④若是FeO、Fe2O3和Fe3O4的混合物,利用极限法判断,若FeO和Fe2O3的混合物,Fe2O3的含量最高为2/3=66.7%,若为Fe3O4和Fe2O3的混合物,Fe2O3的含量最低为1/2=50%,故50%<Fe2O3的物质的量分数<66.7%,答:①若是FeO和Fe2O3的混合物,则它们的物质的量之比为1:2;②若是Fe3O4和Fe2O3的混合物,则它们的物质的量之比为1:1;③若是FeO和Fe3O4的混合物,不合理;④若是FeO、Fe2O3和Fe3O4的混合物,50%<Fe2O3的物质的量分数<66.7%。
本题难度:一般
3、选择题 铁和铁合金是生活中常用的材料,下列说法正确的是
A.一定条件下,铁粉可与水蒸气反应
B.不锈钢是铁合金,只含金属元素
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
参考答案:A
本题解析:A、正确;B、不锈钢中含非金属碳,错误;C、不锈钢包括耐弱腐蚀介质腐蚀的钢,它和盐酸能反应,错误;D、在空气中,镀锌铁板比铁板更耐腐蚀,错误。
本题难度:一般
4、填空题 利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下:
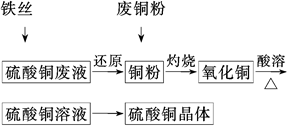
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有______________________________________________
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是___________________
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
参考答案:(1)Fe2O3+6H+=2Fe3++3H2O,
2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑
(2)C或CO 2CuO+C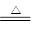 2Cu+CO2↑或CuO+CO
2Cu+CO2↑或CuO+CO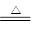 Cu+CO2
Cu+CO2
(3)2Cu+O2+2H2SO4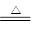 2CuSO4+2H2O
2CuSO4+2H2O
(4)生成等量CuSO4晶体所消耗的H2SO4更多,且会产生污染大气的气体
本题解析:废铁丝中含有铁锈(Fe2O3·xH2O),所以在用稀硫酸处理时可能发生的反应有:Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑;废铜粉在灼烧后得到的产物中含有单质铜,可能是原来杂质中含有C等还原性杂质导致;Cu在不断通入氧气和加热的条件下,可溶解于稀硫酸中,发生反应2Cu+O2+2H2SO4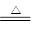 ?2CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓)
?2CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓)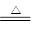 CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。
CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。
本题难度:一般
5、选择题 将铝片投入硫酸铜溶液中,会出现下列现象:铝片表面立刻有紫红色物质沉积,同时产生较多气泡,继而产生蓝色沉淀,混合物温度升高甚至发烫,产生气泡速率明显加快,铝片上下翻滚,溶液中出现黑色物质……。对以上现象的说法错误的是(? )
A.铝片表面的紫红色沉积物为Cu ,离子方程式为2Al+3Cu2+=3Cu+2Al3+
B.生成的气体是H2,生成的蓝色沉淀为Cu(OH)2,产生该现象的离子方程式为3Cu2++6H2O+2Al=3Cu(OH)2↓+3H2↑+2Al3+
C.一段时间后反应速率明显加快的原因一定是;反应放热,使溶液温度升高,反应速率加快
D.溶液中出现的黑色物质可能是氧化铜
参考答案:C
本题解析:铝比铜活泼,和硫酸铜可发生置换反应生成铜,A正确。进而构成原电池,铝是负极加快反应速率,氢离子在正极放电,所以选项C是错误的。反应放热,有可能使氢氧化铜分解生成氧化铜,所以答案选C。
本题难度:一般