微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据金属的不同分类方法可知镁、铝都属于(?)
A.黑色金属
B.轻金属
C.稀有金属
D.有色金属
参考答案:BD
本题解析:根据密度对金属分类,镁和铝都在密度小的轻金属之列;从金属的颜色来分类,镁和铝都不属于黑色金属,而是有色金属。
本题难度:简单
2、选择题 NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料的产品(或物质)是( )。
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
A.①②③④⑤
B.①②③④
C.①②③⑤
D.①②④⑤
参考答案:A
本题解析:在氯碱工业中,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,H2与Cl2化合被水吸收可得盐酸。2NaCl(熔融)
2NaOH+H2↑+Cl2↑,H2与Cl2化合被水吸收可得盐酸。2NaCl(熔融) 2Na+Cl2↑。在制纯碱工业中主要利用如下原理:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;2NaHCO3
2Na+Cl2↑。在制纯碱工业中主要利用如下原理:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;2NaHCO3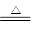 Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
本题难度:一般
3、实验题 (16分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,该水解反应的化学方程式为?。再经过滤、水洗除去其中的Cl–,再烘干、焙烧除去水分得到粉体TiO2。检验TiO2·xH2O中Cl–是否被除净的方法是?。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是?;
②滴定终点的现象是?。
③滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为?。
④下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果?。
若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果?。
参考答案:(1) TiCl4+(2+x) H2O TiO2·xH2O↓+4HCl(3分)
TiO2·xH2O↓+4HCl(3分)
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。(2分)
(2)①抑制 NH4Fe(SO4)2水解(2分)?②溶液变成红色(2分)
③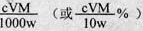 ?(3分)?④偏高(2分)?偏低(2分)
?(3分)?④偏高(2分)?偏低(2分)
本题解析:
⑴水解反应的化学方程式TiCl4+(2+x) H2O TiO2·xH2O↓+4HCl,注意含不定项系数的方程的配平。检验Cl―的方法,取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。⑵①加入一定量H2SO4的原因:NH4+和Fe2+都能发生水解,溶液呈酸性,加H2SO4提高H2SO4的浓度,抑制 NH4Fe(SO4)2水解。②滴定终点的现象是溶液变成红色
TiO2·xH2O↓+4HCl,注意含不定项系数的方程的配平。检验Cl―的方法,取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。⑵①加入一定量H2SO4的原因:NH4+和Fe2+都能发生水解,溶液呈酸性,加H2SO4提高H2SO4的浓度,抑制 NH4Fe(SO4)2水解。②滴定终点的现象是溶液变成红色
③ω(TiO2)= ④NH4Fe(SO4)2溶液有少量溅出,使读出的V增大,测定结果偏高;若在滴定终点读取滴定管刻度时,俯视标准液液面,读出的体积变化量偏小,即V值偏小,使测定结果偏低。
④NH4Fe(SO4)2溶液有少量溅出,使读出的V增大,测定结果偏高;若在滴定终点读取滴定管刻度时,俯视标准液液面,读出的体积变化量偏小,即V值偏小,使测定结果偏低。
本题难度:一般
4、选择题 要检验市售的金制首饰是否用纯金制成,方法之一是将饰品浸入某溶液中,过一段时间取出后称量质量是否变化即作出判断,该溶液是(?)
A.盐酸
B.硫酸
C.硝酸
D.王水
参考答案:C
本题解析:盐酸和硫酸与不活泼金属如铜等不反应,所以它们无法检验出金制首饰是否用纯金制成;而王水的氧化性太强,它可以融化金,所以也不能用来检验。只有C选项最恰当。
本题难度:简单
5、填空题 (12分)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。海水中主要含NaCl和MgCl2等。主要步骤如下;
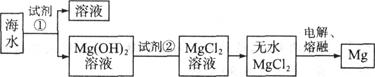
(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用___________,要使MgCl2完全转化为沉淀,加入试剂①的量应___________,验证MgCl2已完全转化为Mg(OH)2的方法是_______________________________。
(2)加入试剂①,能够分离得到Mg(OH)2沉淀的方法是 ____________________ 。
(3)试剂②可以选用___________________________。
(4)无水MgCl2在熔融状态下,通电后会产生Mg,写出该反应的化学方程式
参考答案:

(4)MgCl2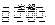 Mg + Cl2↑
Mg + Cl2↑
本题解析:略
本题难度:简单