微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 体积为V mL,密度为ρg·cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol·L-1,质量分数为w %,下列表示式正确的是
A.?c=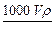
B.?m=Vρ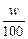
C.?w%=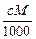 %?
%?
D.?c=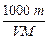
参考答案:B
本题解析:c=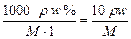 mol·L-1
mol·L-1
m=V·ρ·w%=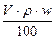
w%=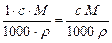
A、C、D错,B对。
本题难度:简单
2、选择题 将标准状况下的a L HCl(气)溶于1L水中,得到的盐酸密度为b g/cm3,则该盐酸的物质的量浓度是
A.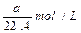
B.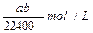
C.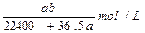
D.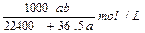
参考答案:D
本题解析:略
本题难度:一般
3、简答题 实验室用浓盐酸配制250mL0.1mol?L-1的盐酸溶液
(1)配制250mL0.1mol?L-1盐酸溶液需要2.0mol?L-1盐酸的体积为______;
(2)要配制上述溶液,需要的仪器除烧杯、玻璃棒外,还有______、______;
(3)配制时,其正确的操作顺序是(填序号字母,每个字母只能用一次)______.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处.
参考答案:(1)根据稀释定律,稀释前后溶质HCl的物质的量不变,设浓盐酸的体积为xmL,则xmL×2mol/L=250mL×0.1mol/L,解得:x=12.5,所以应量取的浓盐酸体积是12.5mL,
故答案为:12.5mL;
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取2.0mol?L-1盐酸(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.
所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,
故答案为:胶头滴管、量筒;250mL容量瓶;
(3)由(2)中的实验操作可知,正确操作顺序为:BCAFED,故答案为:BCAFED.
本题解析:
本题难度:一般
4、计算题 (8分)试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为?。
(2)把1 molNa和1mol Mg分别投入到两杯体积3L浓度1mol/L的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为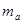 ?
?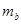 (填“”<、“>”、或“=”)。
(填“”<、“>”、或“=”)。
(3)下图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
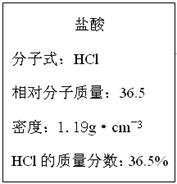
①该浓盐酸中HCl的物质的量浓度为?mol/L。
②标准状况下,1.00L水(密度:1.00g·cm-3)吸收?L的HCl可制得上述浓盐酸。
参考答案:(1)80g/mol(2分)?(2)= (2分)?(3)① 11.9(2分)?②353(2分)
本题解析:(1)根据质量守恒定律可知,生成物C的质量是24g+40g-32g=32g,所以C的摩尔质量是32g÷0.4mol=80g/mol。
(2)1mol钠生成0.5mol氢气,溶液质量增加23g-1g-22g;镁再盐酸的反应中是不足的,生成氢气是1mol,所以溶液增加的质量是24g-2g=22g,所以溶液的质量是相等的。
(3)①根据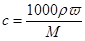 可知,该浓盐酸的物质的量浓度是
可知,该浓盐酸的物质的量浓度是
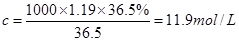 。
。
②设氨气的物质的量是x,则溶液的质量是1000g+17x,则溶液的体积是(1000g+17x)ml,所以溶液的浓度是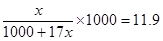 ,解得x=15.76mol,标准状况下的体积是15.76mol×22.4L/mol=353L。
,解得x=15.76mol,标准状况下的体积是15.76mol×22.4L/mol=353L。
本题难度:一般
5、选择题 NA为阿伏佛加德罗常数,下列叙述正确的是(?)
A.标准状况下,22.4L H2O含有的分子数为NA
B.1 mo1·L-1 NaCl溶液中所含有的Na+离子数目为NA
C.标准状况下,22.4L氯气中所含原子数为NA
D.一定条件下,46克钠与足量的H2O完全反应,转移电子数为2NA
参考答案:D
本题解析:A 错误,标况下,水为液体,不是气体
B?错误,没有给溶液体积,不能求出Na+离子数目
C?错误,标准状况下,22.4L氯气中所含原子数为2NA
D 正确,46克钠为2mol完全反应,失去2mol电子,所以,转移电子数为2NA
本题难度:一般