微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 在氯化铵溶液中撒入镁粉有何现象?并分析其原因。
参考答案:由于NH4Cl中NH4+离子水解,使溶液呈酸性。镁粉不断与溶液中H+离子反应放出氢气,NH4+水解平衡右移,c(NH3)越来越大,最后NH3挥发,因此挥发出来的气体有刺激性气味。
NH4++H2O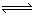 NH3·H2O+H+
NH3·H2O+H+
Mg+2H+=Mg2++H2↑
总的反应方程式是:
2NH4++Mg=2NH3↑+Mg2++H2↑
本题解析:镁是较活泼的金属之一,而氯化镁属易水解的强酸弱碱盐。在溶液中它们之间的反应是水解和置换反应同时存在。
由于NH4Cl中NH4+离子水解,使溶液呈酸性。镁粉不断与溶液中H+离子反应放出氢气,NH4+水解平衡右移,c(NH3)越来越大,最后NH3挥发,因此挥发出来的气体有刺激性气味。
NH4++H2O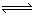 NH3·H2O+H+
NH3·H2O+H+
Mg+2H+=Mg2++H2↑
总的反应方程式是:
2NH4++Mg=2NH3↑+Mg2++H2↑
本题难度:一般
2、计算题 准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛100 mL某浓度的H2SO4溶液烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生沉淀的质量W与加入NaOH溶液的体积V的关系如图所示。
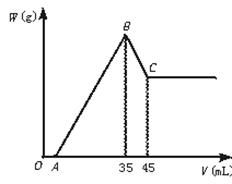
求(1)H2SO4溶液的物质的量浓度是多少?
(2)若A="2.3" mL,铝土矿中Al2O3的质量百分含量是多少?
参考答案:(1)1.75 mol·L-1? (2)85%
本题解析:分析图象时要紧紧抓住起点(A点)、拐点(B点、C点),把隐含因素挖掘出来,使整个过程清晰、连续地展现在眼前。
弄清OA、O到35、45时沉淀的组成和质量。OA段意味着H2SO4过量,O到35时的B点沉淀最多,有Al(OH)3↓、Fe(OH)3↓,C点仅剩下Fe(OH)3。
加入10 mol·L-1 NaOH,即把Al(OH)3↓ AlO
AlO 。
。
(1)B点时沉淀最多,溶液为Na2SO4溶液,据电荷守恒,n(Na+)=2n(SO )。又据元素守恒,n(Na+)=n(NaOH)="10" mol·L-1×0.035 L,n(SO
)。又据元素守恒,n(Na+)=n(NaOH)="10" mol·L-1×0.035 L,n(SO )=n(H2SO4)=c(H2SO4)×0.1,所以c(H2SO4)="1.75?" mol·L-1。
)=n(H2SO4)=c(H2SO4)×0.1,所以c(H2SO4)="1.75?" mol·L-1。
(2)沉淀Al3+所耗OH-的量,是使Al(OH)3溶解所耗OH-的3倍,即沉淀Al3+所耗NaOH为30 mL。
n(Al2O3)= n(NaOH)=
n(NaOH)= ×(10 mol·L-1×0.03 L)="0.05" mol
×(10 mol·L-1×0.03 L)="0.05" mol
m(Al2O3)="0.05" mol×102 g/mol="5.1" g
Al2O3%= ×100%=85%
×100%=85%
本题难度:简单
3、选择题 向盛有AlCl3、MgCl2混合溶液的烧杯中,逐滴滴入NaOH溶液,则下列图像变化趋势正确的是( )
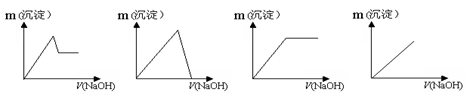
A、 B、 C、 D、
参考答案:A
本题解析:向盛有AlCl3、MgCl2混合溶液的烧杯中,逐滴滴入NaOH溶液,首先NaOH与AlCl3、MgCl2混合溶液反应生成氢氧化镁、氢氧化铝沉淀;再滴入NaOH溶液,氢氧化铝为两性氢氧化物,会逐渐溶解,而氢氧化镁不溶于氢氧化钠溶液,所以正确的选项为A。
本题难度:简单
4、填空题 (已知锌与铝具有一定的相似性,如都能在强碱性溶液中形成酸根阴离子。实验室分析白铁(镀锌的铁)样品成分,称取1.00 g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到有大量气体冒出,后来放出气体速率变慢,至不再放出气体。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加强热至质量不变,最后得到1.20 g红色粉末。
(1)白铁镀锌的作用是______________;盖玻璃片的作用是____________。
(2)放出气体速率由快变慢的原因是_______________________________________。
(3)为什么要加入过量NaOH溶液__________________________________________。
(4)样品中锌的质量分数是_______________________________________________。
参考答案:(1)在铁表面形成保护层,减缓铁的锈蚀?防止气泡逸出时使溶液溅出
(2)一开始是锌与酸反应,锌与铁构成原电池,后来仅是铁反应
(3)使铁元素转化成碱沉淀,而锌元素则以Zn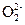 形式存在在溶液中
形式存在在溶液中
(4)16%
本题解析:锌在空气中可形成一层致密的氧化膜保护层,阻止里面铁的锈蚀。当金属与酸反应时,随着气泡的放出,会有少部分液体飞溅,加盖是为了不使溶液飞溅出烧杯,减小实验误差。当向反应后的溶液(含Zn2+、Fe2+)中加入过量NaOH溶液时,Zn2+转化为ZnO2-2而存在于溶液中,而沉淀是Fe(OH)2,但氢氧化亚铁不稳定,在空气中即被氧化成红褐色的氢氧化铁,强热后得到的1.20 g是Fe2O3,根据铁元素守恒,原金属混合物中含有铁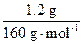 ×2×56 g·mol-1="0.84" g。
×2×56 g·mol-1="0.84" g。
本题难度:一般
5、选择题 化学与生活、社会密切相关。下列说法不正确的是
[? ]
A.用浓H2SO4刻蚀工艺玻璃上的纹饰
B.用含Al(OH)3的药物治疗胃酸过多
C.用Ca(OH)2处理酸性废水
D.用加入Na2S的方法除去废水中的Hg2+
参考答案:A
本题解析:
本题难度:简单