微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如图
所示。请回答下列问题:
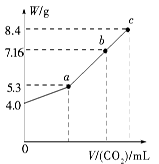
(1)b点时M的组成成分为______________________。
(2)若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________L(标准状况下)。
(3)若向生成的7.16 g盐的溶液中加入一定量的某物质,充分反应后,减压低温蒸发得到纯净的碳酸钠固体(无结晶水)8.4 g。
①若只加入0.03 mol某物质,则加入的物质可以是________或________;
②若只加入0.06 mol某物质,则加入的物质可以是________、________或________。
(4)常温下,同浓度的碳酸钠溶液和碳酸氢钠溶液的pH
都大于7,二者中________的pH更大,理由是________________________;0.1 mol·L-1碳酸钠溶液中离子浓度的大小关系是________;向碳酸氢钠溶液中逐滴滴入氢氧化钡溶液,发生反应的离子方程式为________。
参考答案:(1)Na2CO3和NaHCO3 (2)0.448
(3)①Na2O Na2O2 ②Na NaOH NaH
(4)Na2CO3 在相同条件下,CO32—的水解能力比HCO3—的水解能力强 c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+) Ba2++2OH-+2HCO3—=BaCO3↓+CO32—+2H2O
本题解析:(1)由图象知,开始时氢氧化钠为4.0 g,物质的量为0.1 mol,若全部生成碳酸钠,则W为5.3 g;若全部生成碳酸氢钠,则W为8.4 g,b点对应的固体M为7.16 g,介于5.3 g和8.4 g之间。故b点对应的固体为碳酸钠和碳酸氢钠的混合物。(2)设b点对应的固体中碳酸钠、碳酸氢钠的物质的量分别为x、y,则有106 g·mol-1×x+84 g·mol-1×y=7.16 g,2x+y=0.1 mol,解得:x=0.02 mol,y=0.06 mol。由Na2CO3+H2O+CO2=2NaHCO3得,n(CO2)=0.02 mol。(3)8.4 g Na2CO3的物质的量为0.08 mol,依题意,0.06 mol NaHCO3―→0.06 mol Na2CO3,则发生的反应为NaHCO3+NaOH=Na2CO3+H2O,n(NaOH)=0.06 mol,溶于水产生氢氧化钠的物质中,钠、过氧化钠、氧化钠、氢化钠(NaH+H2O=NaOH+H2↑)不引入新杂质。
本题难度:一般
2、选择题 正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.次氯酸的电子式: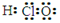
B.质量数为16的氧原子:
C.乙烯的结构简式:
D.碳酸氢根离子的电离方程式: HCO3-+ H2O H3O++ CO32-
H3O++ CO32-
参考答案:D
本题解析:A、次氯酸的电子式: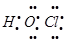 ,错误;B、质量数为16的氧原子:
,错误;B、质量数为16的氧原子: ,错误;C、乙烯的结构简式:CH2=CH2,错误;D、碳酸氢根离子的电离方程式: HCO3-+ H2O
,错误;C、乙烯的结构简式:CH2=CH2,错误;D、碳酸氢根离子的电离方程式: HCO3-+ H2O ?H3O++ CO32-,正确。
?H3O++ CO32-,正确。
本题难度:一般
3、选择题 24 mL0.05 mol·L-1的Na2SO3溶液恰好与40 mL 0.02 mol·L-1的K2RO4酸性溶液反应生成硫酸钠,则元素R在还原产物中的价态是
A.+6
B.+3
C.+2
D.0