微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学用语表示正确的是?
A.中子数为8的N原子: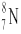
B.离子结构示意图: 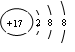 只能表示
只能表示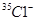
C.碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3-
D.作为相对原子质量标准的碳原子: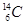
参考答案:C
本题解析:选项A、对于原子的描述,在元素符号的左上角应为该元素原子的质量数,左下角的数字应表示的是该元素的质子数。
选项B、也可表示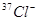 。
。
选项C、碳酸氢钠是一种可溶性盐,在水中能完全溶解,因此此电离方程式正确。
选项D、作为相对原子质量标准的碳原子为  。故答案选C。
。故答案选C。
点评:属于基础题,掌握课本相关概念,尤其是对概念的延伸,即可解答。
本题难度:简单
2、选择题 下列有关化学用语表示正确的是(?)
A.漂白粉有效成分的化学式:CaClO
B.Na+的结构示意图:
C.原子核内有10个中子的氧原子: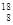 O
O
D.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32—
参考答案:C
本题解析:
试题解析:A、漂白粉的有效成分的化学式应为Ca(ClO)2,错误;B、Na+的原子核内应有11个质子,错误;C、818O原子核内有10个中子,正确;D、NaHCO3在水溶液中的电离方程式应为:NaHCO3=Na++HCO3-,错误,答案选C。
本题难度:一般
3、选择题 在下列有关氧化还原反应的叙述中,正确的是(? )
A.反应中当有一种元素被氧化时,一定有另一种元素被还原
B.反应中不一定所有元素的化合价都发生变化
C.某元素从游离态变成化合态,该元素一定被氧化
D.氧化还原反应中的反应物,不是氧化剂,就一定是还原剂
参考答案:B
本题解析:略
本题难度:一般
4、选择题 关于如下反应:HgS+O2 ?Hg+SO2,下列叙述不正确的是
?Hg+SO2,下列叙述不正确的是
A.该反应是置换反应
B.该反应转移了4e-
C.Hg是被还原得到的产物
D.HgS既是还原剂又是氧化剂
参考答案:B
本题解析:该反应为置换反应,也一定为氧化还原反应,其中汞元素化合价由+2价降至0价,氧元素由0价降至—2价,而硫元素由—2价升至+4价,故HgS既是还原剂又是氧化剂,反应中转移电子数为6e-,答案为B
本题难度:简单
5、填空题 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+2 Na2SO4 + 2 H2O
(1)方法一的离子方程式为 。
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L。
(3)与方法一比较,用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
参考答案:(1)2ClO3-+ 4 H+ + 2Cl-=2 ClO2↑+ Cl2↑+ 2 H2O
(2)H2O2,2.24
(3)方法一制得的ClO2中含有Cl2
本题解析:
试题解析:(1)根据离子方程式的书写原则,易溶且易电离的电解质在书写离子方程式时写成离子形式,删去方程式两边不参加反应的离子,检查方程式两边是否满足元素守恒、电荷守恒,所以方法一的离子方程式为:2ClO3-+ 4 H+ + 2Cl-=2 ClO2↑+ Cl2↑+ 2 H2O。
(2)根据氧化还原反应理论,被氧化的物质是元素化合价升高的物质,在方法二中,化合价升高的元素是H2O2中的氧元素,所以被氧化的物质是H2O2。每生成1mol ClO2气体,则转移1mol电子,所以当有0.1mol电子转移时,则生成0.1mol ClO2气体,标准状况下的体积为2.24L。
(3)氯气用于自来水消毒时易产生对人体有害的有机氯代物,方法一中有氯气产生,所以方法二更适合制备 ClO2。
考点:考查离子方程式的书写、氧化还原反应理论的运用以及化学在生活中的应用
本题难度:一般