微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Cl2与SO2混合均匀后,分别通入到少量下列溶液中,溶液颜色一定会褪去的是
A.I2与淀粉混合溶液
B.KMnO4溶液
C.品红溶液
D.紫色石蕊试剂
参考答案:C
本题解析:当Cl2与SO2 1:1混合后通入溶液能够发生反应,Cl2+SO2+2H2O=H2SO4+2HCl,当Cl2过量,在溶液中能够与水继续反应,生成盐酸和次氯酸,次氯酸具有氧化性;当SO2过量时,能够与水反应生成亚硫酸,亚硫酸具有漂白性。A选项,I2与淀粉混合溶液呈蓝色,若SO2过量,I2与SO2发生氧化还原反应,蓝色褪去;但Cl2过量则不能发生。B选项,若SO2过量,KMnO4能与其发生氧化还原反应,但Cl2过量则不能发生。C选项正确,若Cl2过量,产生的次氯酸能够使品红褪色,若SO2过量,产生的亚硫酸同样能使品红褪色。D选项,Cl2过量紫色石蕊试剂为红色。故本题选择C选项。
本题难度:一般
2、填空题 (14分)?亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以 氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
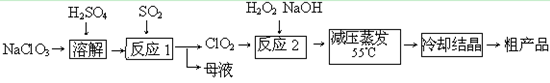
(1)提高“反应1”反应速率的措施有_________________、___________等。
(2)“反应2”的的氧化剂是_________,该反应的化学方程式为_____________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是______________________。
(4)从“母液”中可回收的主要物质是_________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。
参考答案:(1)适当升高反应温度,增大吸收液浓度,增大 与吸收液的接触面积
与吸收液的接触面积
(2) ?
?
(3)常压蒸发温度过高,亚氯酸钠容易分解
(4) ?(5)过滤
?(5)过滤
本题解析:略
本题难度:一般
3、填空题 氯气与水反应的离子方程式为________________,新制的氯水呈_____________色,说明氯水中含有_____________分子。向氯水中滴入几滴硝酸银溶液,立即有_____________生成,说明氯水中有_____________存在,该反应的离子方程式是______________。蓝色石蕊试纸遇到氯水后,首先变红,但很快又_____________,这是因为___________。氯水经一段时间光照后,黄绿色逐渐消失,并放出_____________,说明____________。
参考答案: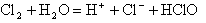 ;黄绿色;
;黄绿色; ; 白色沉淀;
; 白色沉淀; ;
; 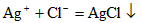 ;褪色; 氯水中的次氯酸将石蕊试液漂白; 无色气体;
;褪色; 氯水中的次氯酸将石蕊试液漂白; 无色气体;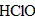 不稳定,易分解放出氧气
不稳定,易分解放出氧气
本题解析:
本题难度:一般
4、计算题 将2.80 g CaO与500 mL某浓度的盐酸充分反应,将所得溶液平均分成两份。向其中一份中加入足量的AgNO3溶液,生成的沉淀干燥后的质量为14.4 g;向另一份溶液中加入足量Zn粒,产生0.560 L(标准状况)气体。计算所用盐酸中HCl的物质的量浓度。
参考答案:0.400 mol·L-1
本题解析:CaO+2HCl====CaCl2+H2O
Zn+2HCl====ZnCl2+H2↑
由于Zn跟HCl反应放出H2,知CaO与盐酸反应中盐酸过量,CaO全部与HCl反应生成CaCl2,即所得溶液是CaCl2和HCl的混合液。
法一:守恒法
Ag++Cl-====AgCl↓
Cl-全部来自于盐酸中
c(HCl)=n(Cl-)=n(AgCl)×2=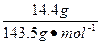 ×2≈0.200 mol
×2≈0.200 mol
c(HCl)= ="0.400" mol·L-1。
="0.400" mol·L-1。
法二:关系式(量)法
跟CaO反应的盐酸
n1(HCl)=2n(CaO)=2× ="0.100" mol
="0.100" mol
跟Zn反应的盐酸
n2(HCl)=2×2n(H2)=2×2× ="0.100" mol
="0.100" mol
总盐酸量n(HCl)="0.200" mol
c(HCl)= ="0.400" mol·L-1。
="0.400" mol·L-1。
本题难度:简单
5、选择题 下列实验现象或结果一定不可能出现的是
[? ]
A.向NaI溶液中滴加几滴AgNO3溶液,产生黄色沉淀,再加入稀硝酸,沉淀不溶解,但溶液由无色变为黄色
B.向浓HNO3中滴加紫色石蕊试液,加热最终变为无色溶液
C.向稀盐酸中滴加NaAlO2溶液,无沉淀产生
D.讨量的Fe在氯气中燃烧,最终产物是FeCl2
参考答案:D
本题解析:
本题难度:一般