| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《原电池原理》考点巩固(2017年最新版)(四)
 (3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量.写出其完全燃烧的热化学方程式: 。 (4)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验: 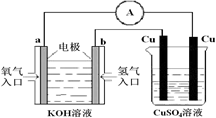 上图装置中,某一铜电极的质量减轻 6.4g ,则 a 极上消耗的O2在标准状况下的体积为 L。 参考答案:(1) C; (2) b;吸热;(3) 2H2(g)+O2(g)=2H2O(l) △H= -571.6 kJ/mol; (4) 1.12L 。 本题解析:A.电解水消耗大量的电能,不经济,错误;B.锌和稀硫酸反应,由于Zn的热还原法冶炼,硫酸是化工试剂,制取成本较高,在制取过程中会产生大气污染,不安全,错误;C.光解海水,海水原料来源广泛,太阳光也充足,成本低,安全系数大,正确;D.分解天然气,消耗大量的化石能源,还消耗大量的其它能源,成本高,不经济,错误;(2)由于催化剂能够降低反应的活化能,使反应在较低的温度下进行,反应速率大大加快,所以表示使用催化剂是曲线是b;因为生成物的总能量高于反应物的总能量,所以该反应是吸热反应;(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量,则其完全燃烧的热化学方程式是:2H2(g)+O2(g)=2H2O(l) △H= -571.6 kJ/mol;(4)在同一闭合电路中电子转移的数目相等。n(Cu)=6.4g÷64g/mol=0.1mol,Cu是+2价的金属,所以n(e-)=0.2mol。由于每1mol的O2反应转移电子4mol,所以若只有0.2mol的电子,则反应消耗氧气的物质的量是0.2mol÷4=0.05mol,在标准状况下,体积是V=0.05mol×22.4L/ mol=1.12L。 本题难度:困难 4、填空题 如图示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧.在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如右表). 参考答案:A-Cu连接时,电子从A→Cu,所以A的金属性大于铜; 本题解析: 本题难度:一般 5、填空题 在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片口只发生电化学腐蚀,当在铜片上共放出2.24 L气体(标准状况)时,稀H2SO4刚好用去一半,则产生这些气体消耗锌___________g,共有___________mol电子通过导线,原H2SO4溶液的浓度是________mol/L 参考答案:6.5,0.20,1.0 本题解析:有关的电极反应为:负极Zn-2e-====Zn2+正极2H++2e-====H2↑n(H2)=0.10mol,则转移的电子为0.20mol,则n(Zn)=0.10mol,m(Zn)=6.5g。 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《综合实验方.. | |