微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (9分)8.34gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
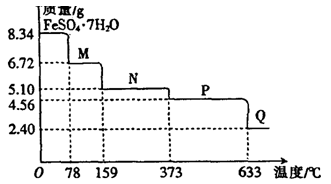
请回答下列问题:
(1)试确定78℃时固体物质M的化学式:??。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式??。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
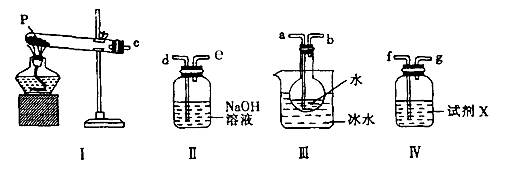
①试剂X的名称是???。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ ?。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量??(填计算式)?。
2、简答题 四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
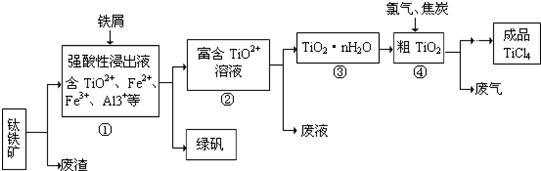
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生.
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是______.
(2)在②→③工艺中需要控制条件以形成TiO2?n?H2O溶胶,该分散质颗粒直径大小在______范围.
(3)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是______(只要求写出一项).
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用______方法.
| TiCl4 | SiCl4
熔点/℃
-25.0
-68.8
沸点/℃
136.4
57.6
3、实验题 某化学课外小组用下图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
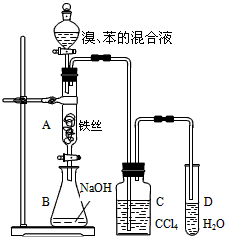
(1)写出A中反应的化学方程式:______________________________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______________________。 (3)C中盛放CCl4的作用是______________________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。

4、实验题 工业上将纯净干燥的氯气通入到0.375 mol/L NaOH溶液中得到漂白水。某同学想在实验室探究Cl2的性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸反应可以制取Cl2。
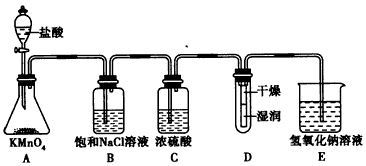
(1)配制物质的量浓度为0.375 mol/L NaOH溶液时,用托盘天平称取所需的NaOH质量为__________。
(2)浓硫酸的作用是______________________。
(3)装置E中发生化学反应方程式为______________________________。
(4)装置B中饱和NaCl溶液的作用是_______________。
(5)实验时装置D中湿润的部分红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因;如需改进,请简述设计方案(若认为合理,则此问可不作答)___________________。
(6)氯元素含量为10%的漂白水溶液355 g,其中含NaClO的物质的量为___________mol。
5、填空题 Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
⑴ 甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是?;
⑵ 乙同学为验证Fe能和热的浓HNO3反应,设计了如下图所示的实验装置,请你指出装置中的不足之处?;?;
?。

⑶ 丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。
丙同学依据反应现象得出Cu片溶解的原因可能是和HNO3发生反应。他依据的反应现象是?;请写出Cu片和稀HNO3反应的离子方程式?
你认为Cu片溶解的不同于丙同学的理由是?
⑷ 请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象?
?。
|