微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 高铁酸钾的确是一种新型、高效、多功能水处理剂,应用前景广阔.实验室以次氯酸盐和铁盐为原料制备少量高铁酸钾的操作步骤如下:
(1)制备次氯酸钾强碱性饱和溶液:①在100mL水中溶解56gKOH,冷至室温后倒入三口瓶中(装置见右图),

冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
①石灰乳的作用是______.石灰乳参与反应的化学方程式______.
②反应过程中和保存饱和次氯酸钾中用冷水浴冷却的原因是______
______(以必要文字和方程式加以说明).
③在上述制备过程中不断搅拌原因是______(以必要文字加以说明).
(2)合成高铁酸钾:将次氯酸钾饱和溶液转入烧杯,冷水浴冷却,在剧烈搅拌下分次加入13.5g研细的FeCl3?6H2O,立即产生大量紫黑色K2FeO4.加少量稳定剂Na2SiO3?9H2O和CuCl2?2H2O,反应30min后,分次加入100gKOH固体,保持温度在20℃以下,陈化30min,用玻璃砂芯漏斗抽滤,得高铁酸钾粗品.
①写出合成高铁酸钾的离子方程式______.
②13.53gFeCl3?6H2O理论上可制得高铁酸钾______g.
(3)高铁酸钾的净水原理:①高铁酸钾在水中发生反应生成Fe(OH)3胶体.写出化学方程式______
______.②高铁酸钾作为水处理剂发挥的作用是______、______.
参考答案:(1)①氯气有毒,污染空气,石灰乳与氯气反应方程式为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.石灰乳除去未反应氯气,防止氯气污染空气.
故答案为:除去未反应氯气,防止氯气污染空气;2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
②温度不同时,氯气与KOH反应的产物也不同,常温下,生成次氯酸钾,受热时生成氯酸钾.温度高时,反应生成氯酸钾,6KOH+3Cl2

5KCl+KClO3+3H2O,降低了次氯酸钾的产量.
故答案为:温度高时,反应生成氯酸钾,6KOH+3Cl2

5KCl+KClO3+3H2O,降低了次氯酸钾的产量.
③反应放热,不利于次氯酸钾的生成.
故答案为:反应放热,不利于次氯酸钾的生成.
(2)①铁离子与氢氧根离子生成氢氧化铁,氢氧化铁被次氯酸根氧化为高铁酸根(FeO42-)同时生成Cl-、H2O.
反应的离子方程式为:Fe3++3OH-=Fe(OH)3,2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
故答案为:Fe3++3OH-=Fe(OH)3,2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
②13.53gFeCl3?6H2O的物质的量为n(FeCl3?6H2O)=13.53g270.5g/mol=0.05mol,根据铁元素守恒可知n(K2FeO4)=0.05mol,所以m(K2FeO4)=0.05mol×198g/mol=9.9g.
故答案为:9.9.
(3))①高铁酸钾与水反应生成氧气和Fe(OH)3(胶体)、氢氧化钾,反应方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2;
故答案为:4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2.
②高铁酸钾与水反应过程中生成原子氧[O]和Fe(OH)3胶体,高铁酸钾与生成原子氧[O]具有强氧化性,杀菌消毒,Fe(OH)3胶体吸附悬浮物质净水.
故答案为:消毒、净水.
本题解析:
本题难度:一般
2、实验题 (6分)某工业废水含有Cu2+、Fe3+、 Al3+、Fe2+、Cl-、NO3-、SO42-、SiO32-中的5种,且各种离子的物质的量浓度相等,均为0.1mol/L。为探究废水的组成,甲同学进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)由Ⅰ判断,溶液中一定不含有的阳离子是?(写离子符号);
(2)Ⅱ中生成的无色气体是 ?,生成无色气体的反应中被氧化的离子是?;
(3)甲同学最终确定原溶液中所含阳离子是?,阴离子是?(写离子符号);
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是 ?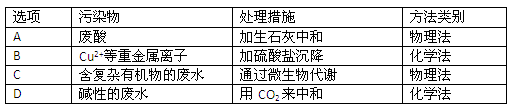
参考答案:(6分)(1)Fe3+(1分)?(2)NO (1分)? Fe2+(1分)?
(3)Fe2+、Cu2+,(1分)? Cl-、NO3-、SO42-?(1分)?(4)D?(1分)
本题解析:(1)取少量溶液,加入KSCN溶液无明显变化,说明不存在铁离子,所以由Ⅰ判断,溶液中一定不含有的阳离子是Fe3+。
(2)另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明无色气体是NO,因此溶液中硬度含有NO3-。NO3-被还原生成NO,说明一定还还原还原性的离子,因此该离子只能是亚铁离子,即生成无色气体的反应中被氧化的离子Fe2+。
(3)向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成,则白色沉淀应该是硫酸钡,所以一定含有SO42-。又因为各种离子的物质的量浓度相等,均为0.1mol/L,所以根据电荷守恒可知,溶液中还存在的离子应该是铜离子和氯离子,不能含有铝离子,因为无法满足电荷守恒。所以最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-。
(4)根据溶液的酸碱性以及离子的性质可知,正确的处理方法是 。
。
点评:该题综合性强,贴近高考,难度较大。该题既有定性的分析,也有大量的计算,增加了试题的难度。有利于培养学生严谨的逻辑推理能力和创新思维能力,有助于提高学生灵活运用基础知识解决实际问题的能力,也有利于培养学生的环境保护意识。
本题难度:一般
3、实验题 ( 16分 ) 某校化学课外兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序: 乙醇的组成元素的测定、分子式的测定、分子结构的测定。
( 1 ) 他们决定用燃烧乙醇分析产物来确定乙醇中含有C、H两种元素。简要说明他们的具体操作: ①证明含有氢元素的操作是 _________________ 。②证明含有碳元素的操作是 ____________________ 。
( 2 ) 要用燃烧分析产物证实乙醇中还含有氧元素时,需取得一些实验数据,这些数据应该是 __________________ 。
( 3 ) 为确定乙醇的分子式,除 ( 2 ) 中数据外,还需不需测定乙醇的相对分子质量?
( 4 ) 为测定乙醇分子结构,他们用了无水乙醇和金属钠反应收集生成氢气的方法,选用了如下图所示的仪器 ( 有的仪器配用双孔橡皮塞 ) 。
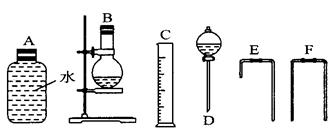
①装置的连接顺序是 ________ 接 _________ 接 _________ 接 _________ 接
__________ 接 ______________ 。
②由实验证明乙醇的分子结构是CH3CH2OH而不是CH3OCH3的理由是 _________________ 。
参考答案:( 1 ) ① 用一干燥的小烧杯倒置在乙醇燃烧火焰上方,烧杯内壁有水珠生成 ②将内壁用澄清石灰水润湿的小烧杯倒置在火焰上方,石灰水变浑浊
( 2 ) 乙醇、二氧化碳及水三种物质的质量
( 3 ) 不需要。
( 4 ) ① DBEAFC
② 乙醇分子中有一个H原子处于与其他原子不同的特殊位置。
本题解析:乙醇燃烧是与氧气反应,只要证明燃烧产物中有H2O、CO2生成,即可证明乙醇中含C、H元素。
本题难度:简单
4、选择题 下列实验方案可行的是
A.比较碳酸和苯酚的酸性强弱:用浓醋酸和Na2CO3反应,产生 的气体直接通入苯酚钠溶液中,看是否有浑浊出现
的气体直接通入苯酚钠溶液中,看是否有浑浊出现
B.证明CH2=CHCH2CHO 中有碳碳不饱和键:滴入KMnO4酸性溶液,看紫红色是否褪去
C.检验淀粉水解产物中有葡糖糖:取少量水解液,加入适量氢氧化钠中和,再向其中滴加新制Cu(OH)2悬浊液,加热,观察现象
D.配制新制Cu(OH)2浊液:向2mL10%NaOH溶液中加入5滴的2%CuSO4溶液
参考答案:CD
本题解析:略
本题难度:简单
5、实验题 (13分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
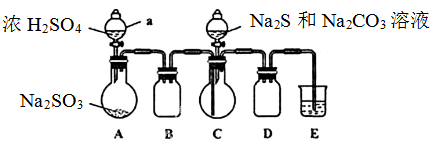
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4? B.NaOH溶液? C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
参考答案:Ⅱ.(1)分液漏斗;B?(3)蒸发
Ⅲ. (1)过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl。
(2)先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液。(3)重结晶
本题解析:Ⅱ.[制备产品]
(1)根据仪器的构造特点可知,仪器a的名称是分液漏斗。根据装置可知,A装置是制备SO2的,C装置是制备得Na2S2O3,BD装置是防倒吸的,由于SO2有毒,需要尾气处理,因此E装置是吸收SO2的。由于SO2是酸性氧化物,可以用氢氧化钠溶液吸收,即E中的试剂是氢氧化钠溶液,答案选B。
(3)由于Na2S2O3·5H2O是无色透明晶体,易溶于水,因此要从溶液中得到硫代硫酸钠晶体,责问需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)Na2S2O3·5H2O的稀溶液与BaCl2溶液混合无沉淀生成,而实验过程中有白色沉淀生成,因此要进一步验证,则可以向白色沉淀中滴加稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)由于亚硫酸盐易被氧化生成硫酸盐,而装置中含有空气,空气能氧化亚硫酸盐,所以为减少装置C中生成的Na2SO4的量,改进后的措施是先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液。
(3)由于Na2S2O3·5H2O的溶解度随温度升高显著增大,因此所得产品通过重结晶方法提纯。
本题难度:一般