微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (13分)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
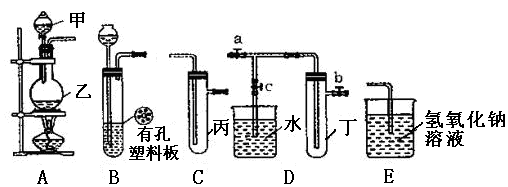
(1)甲、乙两仪器的名称是 、 。
(2)利用B装置可制取的气体有 (写出两种即可)。
(3)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式 。
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验。
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁中。
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 ?mol·L?1(保留2位有效数值,气体按标准状况计算)。
参考答案:(13分)
(1) 分液漏斗、圆底烧瓶(2分)?
(2)H2、CO2 、 H2S等?(2分)
(3)4HCl(浓)+ MnO2 ?MnCl2 + Cl2↑ + 2H2O (3分)
?MnCl2 + Cl2↑ + 2H2O (3分)
(4)①a、b(2分);? c(1分)? ② 0.045?(3分)
本题解析:B装置的特征是有空的隔离板,还有长颈漏斗,相当于是简易的启普发生器,所以可以制取H2、CO2 、 H2S等;A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程是4HCl(浓)+ MnO2 ?MnCl2 + Cl2↑ + 2H2O;欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a,b,再打开止水夹c,使烧杯中的水进入试管丁中;试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是0.045mol·L?1具体的计算过程是:
?MnCl2 + Cl2↑ + 2H2O;欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a,b,再打开止水夹c,使烧杯中的水进入试管丁中;试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是0.045mol·L?1具体的计算过程是:
4NO2+O2+2H2O==4HNO3
假设试管体积是v,所以溶液体积也是v,二氧化氮体积也是v,所以由公式得:n(NO2)=n(HNO3)=v/22,4? mol? c(HNO3)=n(HNO3)/v? ="1/22.4" ="0.045" mol/L2的性质实验
点评:本题重点考查的是NO2的性质实验,学生只要熟练掌握试验的分析方法和与物质的量有关的计算方法,此类问题不难解决。
本题难度:一般
2、选择题 某学生的实验报告所列出的下列数据中合理的是(?)
A.用1mol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3KJ/mol
B.通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量
C.室温下,用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL
参考答案:B
本题解析:醋酸是弱酸,电离时吸热,所以醋酸和氢氧化钠溶液生成1mol水放热小于57.3kJ,A错误;炭与氧气反应生成二氧化碳放热,B正确;广泛pH试纸测得pH值为整数,C错误;滴定管的精确度为0.01mL,D错误。
点评:稀溶液中,强酸和强碱生成1mol水放热57.3kJ。若浓硫酸与氢氧化钠溶液生成1mol水放热大于57.3kJ/mol;若醋酸与氢氧化钠溶液或盐酸与氨水分别生成1mol水放热小于57.3kJ。
本题难度:简单
3、实验题 某同学设计了下图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
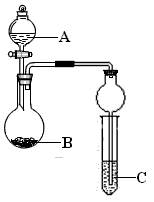
(1)若A为浓氨水,B为烧碱,C为AlCl3溶液,打开分液漏斗旋塞,烧瓶中即有氨气生成,原因是__________ (结合离子方程式回答)。一段时间后,观察到试管中的现象是___________ ,发生反应的离子方程式是______________ 。
(2)利用该装置设计实验证明醋酸、碳酸、苯酚的酸性强弱,若B为碳酸钠,A与B发生反应的离子方程式是____________ ,能得到的相应结论是_____________ ;试管中出现浑浊,依据此现象能否得出相应的结论,请简述理由:_______________ 。
参考答案:(1)在氨水中有下列平衡:NH3+H2O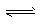 NH3· H2O
NH3· H2O 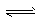 NH4++OH-, NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;有白色沉淀产生;
NH4++OH-, NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;有白色沉淀产生;
Al3+ +3 NH3 · H2O == Al(OH)3↓ + 3 NH4+
(2)CO32-+2CH3COOH→2CH3COO- + H2O+CO2↑;醋酸酸性强于碳酸;不能,因为醋酸具有挥发性,挥发出的醋酸也可以和苯酚钠溶液发生反应,生成苯酚
本题解析:
本题难度:一般
4、实验题 (8分)已知:Cu+2H2SO4(浓)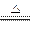 CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。
CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。

(1)写出标号①的仪器的名称:? ?。
(2)将产生气体通入品红试液中的现象为:? ?。
(3)图中棉花团中浸有氢氧化钠溶液,其作用是_________________________? 。
(4)反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应,因此反应完毕,试管中一定还有硫酸剩余。下列药品中能用来证明反应结束后的溶液中确有余酸的有________(填字母)。
a.铁粉? b.BaCl2溶液? c.银粉? d.Na2CO3溶液
参考答案:
小题1:酒精灯
小题2:品红试液褪色
小题3:吸收SO2尾气
小题4:ad
本题解析:略
本题难度:简单
5、填空题 某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.
(1)过氧化钠与二氧化碳反应的化学方程式是______,该反应中,反应物的总能量______?(填“大于”或“小于”)?生成物的总能量.
(2)装置Ⅰ中的试剂是______?(填序号).
a.稀盐酸?b.稀硫酸?c.小苏打?d.石灰石
(3)实验时,应先打开弹簧夹______(填K1或K2?),观察到预期现象后,关闭它,再打开另一个弹簧夹.
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃.
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是______;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是______.
(5)为进一步达到实验目的,应补充的实验是:取最终反应后Ⅲ中所得固体,______.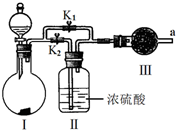
参考答案:(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2?CO2=2Na2CO3+O2,该反应是放热反应,所以反应物的总能量大于生成物的总能量,
故答案为:2Na2O2+2?CO2=2Na2CO3+O2;大于;
(2)盐酸和碳酸钙反应时可能会带出一部分氯化氢,为了使实验更准确应该可用稀硫酸和小苏打反应制二氧化碳,故答案为:bc;
(3)根据实验目的可以知道,先通入干燥的二氧化碳,来判断干燥的二氧化碳是否能够和过氧化钠反应,所以打开的止水夹为K2,故答案为:K2
(4)(3)①二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去二氧化碳,再用带火星的木条来检验是否产生了氧气,
故答案为:除去未充分反应的CO2;
②根据查阅资料部分可以知道,水也能够和过氧化钠反应生成氧气,所以不能判断是二氧化碳和过氧化钠发生了反应,故答案为:水与Na2O2反应生成氧气;
(5)Ⅲ中固体若有碳酸钠,盐酸可以和碳酸钠反应生成二氧化碳,二氧化碳能使澄清石灰水变混浊,故答案为:加入稀盐酸,将产生的气体通入澄清石灰水.
本题解析:
本题难度:一般