微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 分别取4大mL的大?了大mol/L盐酸与4大mL?大.了了mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(o)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、______、______.
(得)为什么中和热测定中要用稍过量的碱(或酸):______
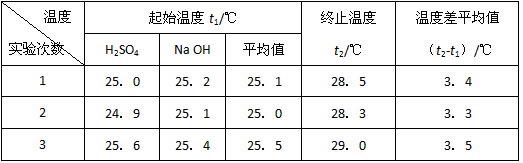
(3)假设盐酸和氢氧化钠溶液的密度都是og/左m3,又知中和后生成溶液的比热容左=4?o8J/(g?℃).为了计算中和热,某学生实验记录数据如下:

依据该学生的实验数据计算,该实验测得的中和热△H=______;?(结果保留一位小数)
(4)上述实验数值结果与中和热的理论值了7.34J/mol有偏差,产生偏差的原因可能是(填字母)______.
a.实验装置保温、隔热效果差?b.量取盐酸与氢氧化钠溶液时仰视读数左.分多次把Na大H溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.
参考答案:(他)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、搅拌器以及量筒,故答案为:环形玻璃搅拌棒;量筒;
(2)在中和热测定的实验中,为了保证酸(或碱)能够完全被中和,往往使得一方过量,故答案为:为了保证酸(或碱)能够完全被中和或通过测量值求算的是反应生成他mql水时的反应热即中和热;
(3)40mL的0?50mql/L盐酸与40mL?0.55mql/L氢氧化钠溶液中,溶液质量m=30mL×他g/mL=30g,c=4?他3J/(g?℃),代入公式△H=Q=cm△x得△H=Q=4.他3J/(g?℃)×30g×(23.2-20.他)+(23.他-20.2)+(25.3-20.5)3=-50.2KJ/mql,故答案为:-50.2KJ/mql;
(4)a.实验装置保温、隔热效果必须好,否则影响实验结果,故a正确;
b.量取NaqH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,故b正确;
c.允许分多次把NaqH溶液倒入盛有硫酸的小烧杯中,故c错误;
d.用温度计测定NaqH溶液起始温度后,要将温度计回零直再测定H2Sq4溶液的温度,故d正确.
故选abd.
本题解析:
本题难度:简单
2、实验题 利用下图装置测定中和热的实验步骤如下:

①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)NaOH溶液稍过量的原因 ____________。
(2)加入NaOH溶液的正确操作是_____________ (填字母)。
A.沿玻璃棒缓慢加入
B.一次迅速加入
C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是__________ 。
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,
请根据实验数据写出该反应的热化学方程式_____________ 。
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量__________ (填“小于”、“等于”或“大于”)57.3 kJ,原因是________________ 。
参考答案:(1)确保硫酸被完全中和
(2)B
(3)用环形玻璃棒轻轻搅动
(4)H2SO4(aq)+2NaOH(aq)== Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ·mol-1
(5)大于; 浓硫酸溶于水放出热量
本题解析:
本题难度:一般
3、选择题 下图为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的是
[? ]
A. 测定中和热 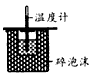
B. 用石灰石和稀盐酸制取CO2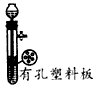
C. 蒸馏石油 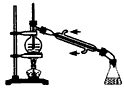
D. 配制溶液中转移溶液 
参考答案:B
本题解析:
本题难度:一般
4、简答题 (1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、量筒、______.
(2)量取反应物时,取50mL?0.50mol?L-1的盐酸,还需加入的试剂是______(填序号).
A.50mL?0.50mol?L-1?NaOH溶液
B.50mL?0.55mol?L-1?NaOH溶液
C.1.0g?NaOH固体
(3)已知稀盐酸与稀氢氧化钠溶液反应的中和热△H=-57.3kJ?mol-1,请用离子方程式表示该中和反应的热化学方程式______.
参考答案:(1)中和热的测定实验用到的玻璃仪器有:烧杯、温度计、量筒、搅拌器,故答案为:搅拌器;
(2)为了保证酸或是碱中的一方完全反应,往往保证一方过量,所以可以选择50mL?0.55mol?L-1?NaOH溶液,故答案为:B;
(3)稀盐酸与稀氢氧化钠溶液反应的中和热热化学反应方程式为:H+(aq)+OH-(aq)=H2O(aq),△H=-57.3kJ?mol-1,
故答案为:H+(aq)+OH-(aq)=H2O(aq),△H=-57.3kJ?mol-1.
本题解析:
本题难度:一般
5、选择题 强酸和强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1分别向1 L 0.5 mol·L-1的NaOH溶液中加入:稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是
A.ΔH1>ΔH3>ΔH2
B.ΔH2>ΔH3>ΔH1
C.ΔH2=ΔH3>ΔH1
D.ΔH1=ΔH2=ΔH3
参考答案:A
本题解析:
本题难度:困难