微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是
A.该反应中Fe2+是还原剂,O2是还原产物
B.4 mol Na2O2在反应中共得到8NA个电子
C.Fe(OH)3是氧化产物,每生成1 mol O2反应过程中共转移6 mol电子
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
参考答案:C
本题解析:A选项中过氧化钠既作氧化剂又作还原剂。B中4mol过氧化钠有6mol的氧原子得到六NA个电子。C选项正确,可只用分析过氧化钠得电子数。D中由于过氧化钠氧化性比较强,反应速率较快,直接出现红褐色沉淀。
点评:本题关键在于分析化合价的升降来确定得失电子的数目。难度不大。
本题难度:一般
2、填空题 (1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反应中物质的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为_____________。
(2)配平下列氧化还原反应方程式:___KMnO4+___H2S+__H2SO4(稀) —— __K2SO4+__MnSO4+__S↓+__H2O
(3)Cl2是一种黄绿色有毒气体,化工厂可用浓氨水来检验有毒气体Cl2是否泄漏,有关反应的化学方程式为:3Cl2+8NH3=6NH4Cl +N2若反应中NH3消耗6.8 g,则转移电子个数为?。
参考答案:(1)
 ? >? 5:2
? >? 5:2
(2)2 KMnO4+5H2S+3H2SO4(稀) ==?1K2SO4+2MnSO4+5S↓+8H2O
(3)0.3 NA或1.80 6×1023个
本题解析:(1)HCl失去10电子给KMO4,且KMnO4作氧化剂,氧化性大于HCl。氧化产物是Cl?2,还原产物是MnCl2。(2)利用电子得失相等和原子个数守恒,可以配平。(3)反应了6.8g的NH3,,实际发生氧化反应的0.1mol NH3,应转移0.3 NA个电子。
本题难度:一般
3、选择题 下列说法正确的是?
A.S02和Cl2都能使品红溶液褪色,且加热后均恢复原色
B.Si02是酸性氧化物,能与NaOH溶液反应
C.高温时,CuO比Cu2O稳定
D.将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化
参考答案:B
本题解析:A项,S02和Cl2都能使品红溶液褪色,但加热后后者不能恢复原色;B项,正确;C.高温时,CuO可以分解为Cu2O,所以Cu2O比较稳定;D项,只能说明铜在冷的浓硫酸中不发生反应。
点评:S02和Cl2都具有漂白性,但二者漂白原理不同,S02是和有色物质结合生成无色的物质,加热后这种物质会重新分解为有色物质,而Cl2是与有色物质发生氧化还原反应,使有色物质分解为无色物质;
本题难度:简单
4、选择题 检验下列物质X是否已部分被氧化变质,所选用的试剂Y不正确的是?(?)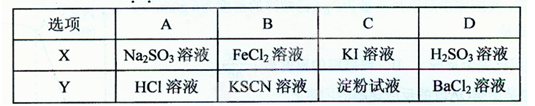
参考答案:A
本题解析:A 错误,Na2SO3部分变质,会得到Na2SO4,应加入酸化的BaCl2,看是否有沉淀生成。
B 正确,加入KSCN,溶液变为血红色,证明FeCl2部分被氧化。
C 正确,加入淀粉,变为蓝色,证明KI部分被氧化
D 正确,加入BaCl2溶液,有白色沉淀,证明部分被氧化。
本题难度:简单
5、填空题 2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有________ mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有__________。
(3)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂中________(填序号)能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_____________________________________(并标出电子转移的数目和方向)。
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
参考答案:(1)NaNO2? 0.75?(2)②?⑤?(3)②?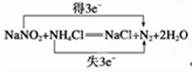
本题解析:(1)根据方程式可知,亚硝酸钠中氮原子的化合价从+3价降低到+2价,得到电子,被还原,剩余氧化剂。0.75mol碘化钾失去0.75mol,所以根据电子的得失守恒可知,被还原的氧化剂也是0.75mol。
(2)亚硝酸钠具有氧化性,能氧化碘化钾,而氯化钠不能。但该反应是在酸性条件小进行的,所以答案选②⑤。
(4)亚硝酸钠转化为氮气,说明亚硝酸钠是氧化剂,所以需要加入还原剂氯化铵,反应的方程式见答案。
本题难度:一般