微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目: __________________。若反应中生成0.2 mol HNO3,转移的电子数目为___________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是______________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外。还肯定有
___________(填化学式)。
参考答案:(1)2∶1
(2)“略”;0.4NA或2.408×1023
(3)泄漏时会看到白雾和红棕色气体,同时闻到刺激性气味
(4)NaNO3
本题解析:
本题难度:一般
2、选择题 下列反应属于氧化还原反应的是
[? ]
A.CaCO3+2HCl=CaCl2+CO2↑+H2O
B.CaO+H2O=Ca(OH)2
C.2H2O2 2H2O+O2↑
2H2O+O2↑
D.CaCO3 CaO+CO2↑
CaO+CO2↑
参考答案:C
本题解析:解析:
选项A.CaCO3+2HCl=CaCl2+CO2↑+H2O 此反应中没有元素化合价发生变化,不是氧化还原反应,故错;
选项B.CaO+H2O=Ca(OH)2此反应中没有元素化合价发生变化,不是氧化还原反应,故错;
选项C.2H2O2 2H2O+O2↑ 此反应中氧元素的化合价由-1价变为0价和-2价,是氧化还原反应,故正确;
2H2O+O2↑ 此反应中氧元素的化合价由-1价变为0价和-2价,是氧化还原反应,故正确;
选项D.CaCO3 CaO+CO2↑此反应中没有元素化合价发生变化,不是氧化还原反应,故错。
CaO+CO2↑此反应中没有元素化合价发生变化,不是氧化还原反应,故错。
故选:C
本题难度:简单
3、填空题 (6分)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为: 2NaIO3+5NaHS O3=3NaHSO4+2Na2SO4+I2+H2O?
O3=3NaHSO4+2Na2SO4+I2+H2O?
(1)反应中_____________元素被氧化, _____________是氧化剂。
(2)用双线桥标出电子转移方向和数目。_____________________________________
(3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
参考答案:
本题解析:略
本题难度:一般
4、选择题 亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,可能生成的产物是
[? ]
A.N2
B.N2O3
C.NH3
D.NO2
参考答案:AC
本题解析:解析:
氧化剂时生成的产物是指化合价降低之后的生成物,HNO2中氮元素为+3价,A、C选项中氮元素的价态均低于+3价,可能为HNO2作氧化剂时,可能生成的产物是,B、D选项中氮元素的价态均高于+3价,不可能为HNO2作氧化剂时生成的产物。故事故A、C正确,B、D错。
故选:A、C
本题难度:简单
5、填空题 (6分)稀硝酸和足量的铁反应的化学方程式如下:
3Fe + 8HNO3 = 3Fe(NO3)2+ 2NO↑+ 4H2O?
(1)该氧化还原反应的氧化剂是?,氧化产物是?。
(2)请用双线桥法表示出电子转移的方向和数目:
3Fe +8HNO3 = 3Fe(NO3)2+2NO↑+4H2O
(3)若生成标准状况下11.2LNO气体,反应中被还原的HNO3的物质的量为________。
参考答案:(共6分)?(1)HNO3;? Fe(NO3)2? (各1分)
(2)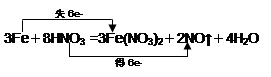 (2分)
(2分)
(3)0.5 mol? (2分)
本题解析:(1)根据反应放热化学方程式可知,铁元素的化合价从0价升高到+2价,失去2个电子;硝酸中氮元素的化合价从+5价降低到+2价,得到3个电子,所以硝酸是氧化剂,硝酸亚铁是氧化产物。
(2)根据电子的得失守恒可知,用双线桥法表示出电子转移的方向和数目为
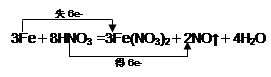
(3)硝酸的还原产物是NO,物质的量是11.2L÷22.4L/mol=0.5mol,所以根据氮原子守恒可知,被还原的硝酸的物质的量是0.5mol。
点评:本题是高考中的常见考点之一,试题难易适中,侧重能力的考查。氧化还原反应判断的关键是准确标出有关元素的化合价变化情况,然后根据有关概念判断即可。而氧化还原反应的计算,则一般利用电子的得失守恒进行。
本题难度:一般